Diagnosticul PID
Diagnosticul diferențial al PID poate fi o provocare din cauza suprapunerii aspectelor clinice, radiologice și patologice1,2

O ABORDARE MULTIDISCIPLINARĂ CARE IMPLICĂ O ANALIZĂ CLINICĂ, RADIOLOGICĂ ȘI PATOLOGICĂ ESTE RECOMANDATĂ PENTRU DIAGNOSTICAREA PRECOCE ȘI PRECISĂ A PID1,3–6
Exemplu de echipă multidisciplinară
Se recomandă ca toate informațiile de diagnostic colectate să fie evaluate de o echipă multidisciplinară cu experiență în diagnosticul PID, care poate fie să stabilească un diagnostic, fie să discute indicația pentru proceduri de diagnostic ulterioare, cum ar fi biopsia pulmonară toracoscopică sau criobiopsia transbronșică.7
Evaluarea randamentului diagnosticului în raport cu riscurile potențiale asociate fiecărei proceduri este crucială pentru discuții între membrii echipei multidisciplinare dar și cu pacienții.7
Algoritm pentru diagnosticul fibrozei pulmonare7
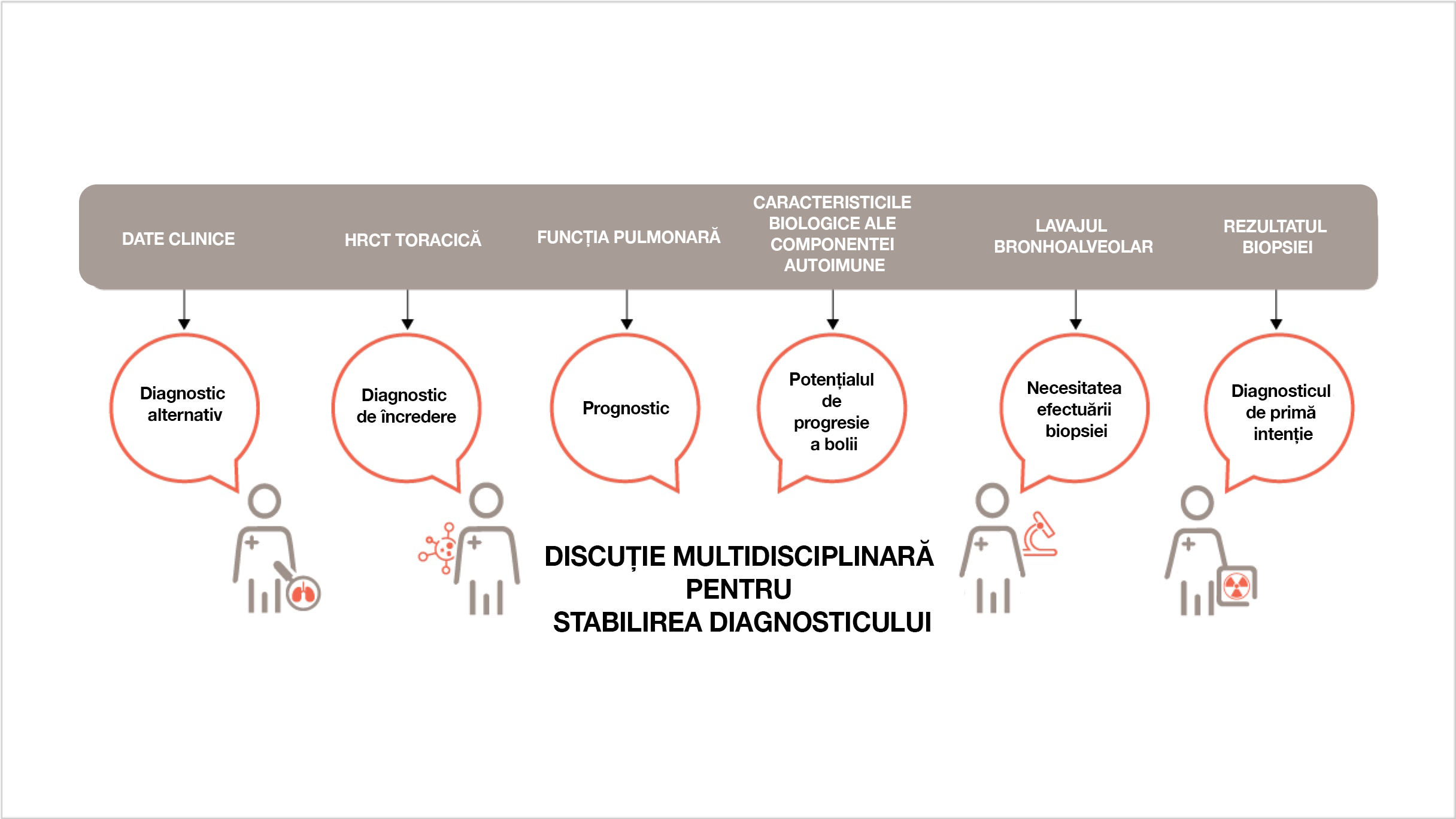
Participanții iau în considerare toate datele disponibile și propun un diagnostic provizoriu de lucru, evaluează necesitatea biopsiei și încrederea în diagnostic și iau în considerare posibilele diagnostice alternative.
Dacă un caz nu poate fi abordat de o echipă multidisciplinară, este important ca medicul curant să realizeze că mulți factori trebuie luați în considerare înainte de a putea fi luate decizii de diagnostic.
Adaptat după: Wijsenbeek M, Cottin V. N Engl J Med. 2020;383:958–968.
Cum puteți utiliza HRCT pentru a diagnostica diferite PID?
Alte considerații pentru diagnosticul PID:
- La auscultația toracică, ralurile crepitante fine sunt sugestive pentru fibroza7
- Trebuie evaluat amănunțit istoricul pacientului, inclusiv expunerile la mediu, utilizarea medicației și simptomele extrapulmonare7
Alte considerații pentru diagnosticul PID în BTC:
- În BTC, PID se poate dezvolta fie după ce BTC a fost diagnosticată, fie înainte de apariția simptomelor reumatologice ale BTC
- Acest lucru face importantă efectuarea de examinări fizice și serologice dacă există vreo suspiciune de PID-BTC7
Ce altceva ar trebui să luați în considerare atunci când diagnosticați PID-BTC?
Ce se întâmplă în cazul în care cauza PID este neclasificabilă după evaluare?
- Unele cazuri de PID rămân neclasificabile chiar și după o evaluare amănunțită.7 În cazul unor noi informații viitoare, un diagnostic de lucru poate deveni ulterior un diagnostic diferențial definitiv.
DIAGNOSTICUL DE FPI
Ghidurile recomandă o abordare multidisciplinară, care implică o evaluare clinică, radiologică și patologică pentru a realiza un diagnostic precoce și precis de FPI:3,9–11

În absența altor cauze cunoscute, HRCT, pus în discuție cu echipa MDT, este necesară pentru a confirma un diagnostic de FPI3,9

Echipele MDT ajung la un diagnostic de FPI mai frecvent și cu o încredere mai mare decât în cazul clinicienilor individuali12
Într-un studiu desfășurat în Australia (n=90), discuția multidisciplinară a dus la modificarea diagnosticului: 10 (37%) din 27 de pacienți referiți inițial cu un diagnostic de FPI au schimbat cu diagnosticul non-FPI și 7 pacienți au avut diagnosticul schimbat la FPI în urma discuției MDT13

Algoritm de diagnosticare pentru un diagnostic precis și în timp util al FPI din ghidurile ATS/ERS/JRS/ALAT3
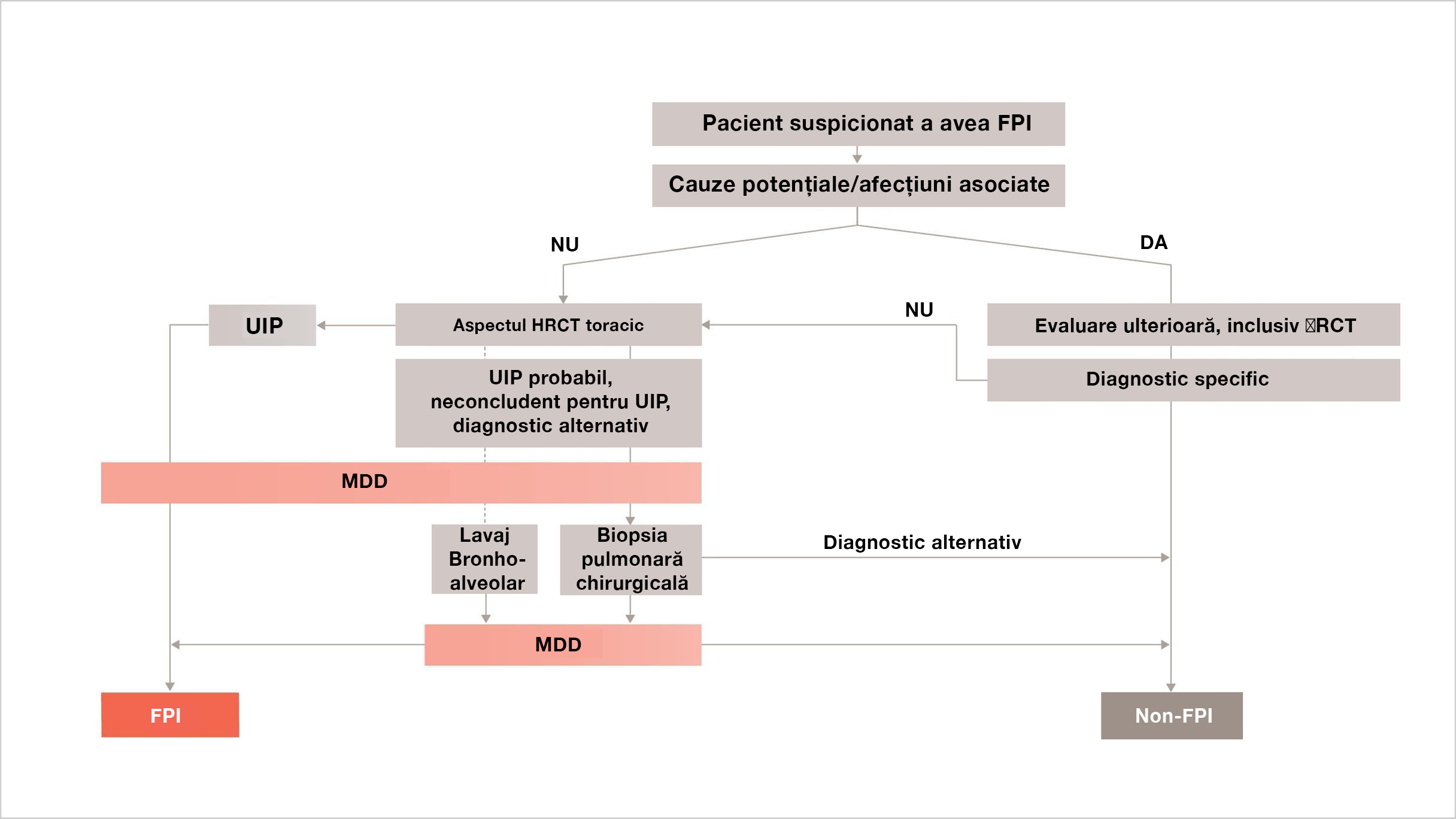
* Biopsia pulmonară chirurgicală nu este indicată la pacienții cu risc crescut de complicații intra-, peri- sau postoperatorii (de exemplu, hipoxemie severă în repaus și/sau hipertensiune pulmonară severă cu o capacitate de difuziune a oxigenului mai mică de 25% după corectarea hematocritului). Biopsia pulmonară chirurgicală poate fi inutilă în unele cazuri familiale.3
Reprinted from Annals of the American Thoracic Society, 183(6), Raghu et al, An Official ATS/ERS/JRS/ALAT Statement: Idiopathic Pulmonary Fibrosis: Evidence-based Guidelines for Diagnosis and Management, p 788–824, ©2022.
Pentru pacienții cu risc de FPI, HRCT trebuie evaluat la prima suspiciune de PID.9
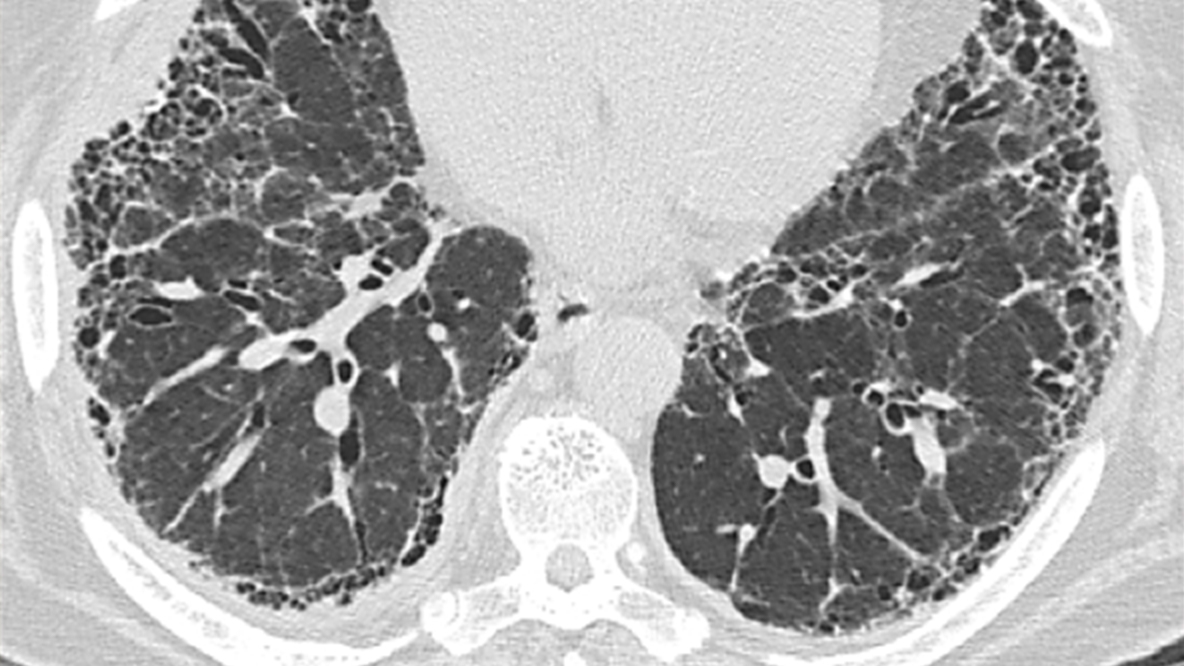
Caracteristicile compatibile cu un model UIP pe HRCT includ:9
Aspect de fagure de miere
Reticulații
Bronșiectazii de tracțiune
Ghidurile ATS/ERS/JRS/ALAT recomandă ca FPI să poată fi diagnosticată cu încredere dacă evaluarea clinică a pacientului indică FPI, iar HRCT arată un aspect probabil de UIP (biopsie cu recomandare condiționată).3
Diagnosticul FPI bazat pe HRCT și modelele relevate de biopsie conform recomandărilor ATS/ERS/JRS/ALAT 20183
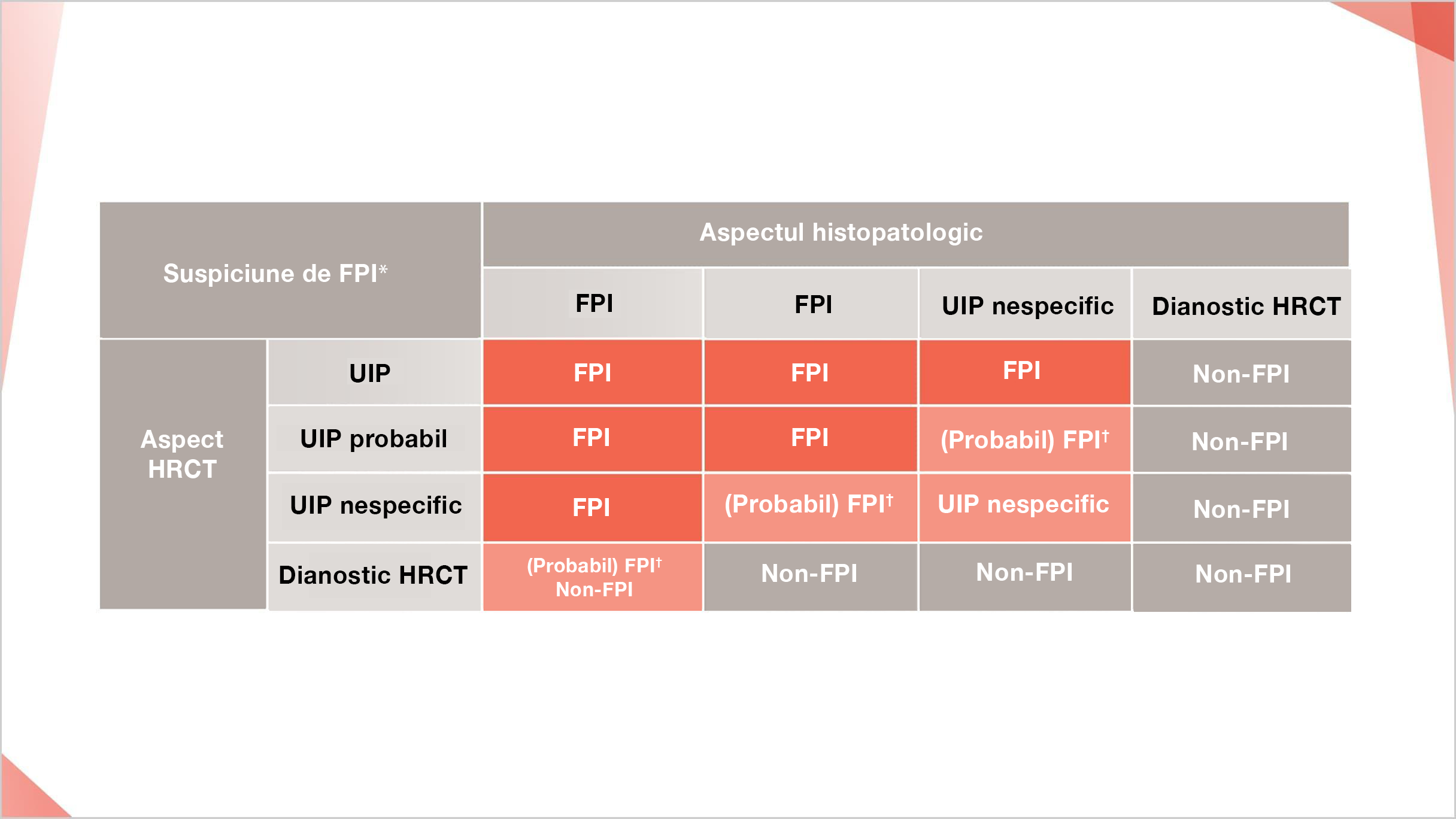
Dacă nu este pus un diagnostic specific sau nu este identificată nicio cauză potențială pentru PID, atunci constatările clinice și combinația adecvată de HRCT și modele histopatologice sunt luate în considerare în timpul discuțiilor multidisciplinare pentru a stabili sau exclude diagnosticul de FPI.3
Reprinted from Annals of the American Thoracic Society, 183(6), Raghu et al, An Official ATS/ERS/JRS/ALAT Statement: Idiopathic Pulmonary Fibrosis: Evidence-based Guidelines for Diagnosis and Management, p788–824, ©2022.
-
*
Pacienții suspicionați clinic cu FPI sunt cei cu modele simptomatice sau asimptomatice inexplicabile de fibroză pulmonară bilaterală pe o radiografie toracică sau tomografie computerizată toracică, raluri crepitante bibazilare și vârsta mai mare de 60 de ani.3
-
†
FPI este diagnosticul probabil atunci când oricare dintre următoarele caracteristici este prezentă:3
-
•
Bronșiectaziile/bronșiolectaziile de tracțiune moderate până la severe (definite ca bronșiectazie/bronșiolectazie de tracțiune ușoară în patru sau mai mulți lobi, inclusiv lobul lingual sau bronșiectazie de tracțiune moderată până la severă în doi sau mai mulți lobi) la un bărbat peste 50 de ani sau la o femeie peste 60 de ani.
-
•
Reticulații extinse (>30%) pe HRCT și vârsta >70 de ani
-
•
Creșterea numărului de neutrofile și/sau absența limfocitozei în lichidul din BAL
-
•
Discuția multidisciplinară ajunge la un diagnostic sigur al FPI
-
‡
FPI nespecific3
-
•
Fără o biopsie adecvată este puțin probabil să avem FPI
-
•
Cu o biopsie adecvată poate fi reclasificat la un diagnostic mai specific după discuții multidisciplinare și/sau consultații suplimentare
DIAGNOSTICUL PNEUMONIEI INTERSTIȚIALE IDIOPATICE NESPECIFICE (PIINS)
Testele de diagnosticare pentru PIINS implică:


HRCT
(opacități cu aspect de sticlă mată; opacități reticulare predominent în zonele pulmonare inferioare; micronoduli; condensare; aspect minim de fagure de miere)16
Biopsie pulmonară chirurgicală
(care arată uniformitatea implicării interstițiale) utilizat atunci când HRCT sugerează NSIP, model care se suprapune cu modelele OP și DIP15,17
O discuție multidisciplinară care implică pneumologi, radiologi și histopatologi este recomandată în cazurile în care caracteristicile clinice, radiologice și patologice nu sunt certe sau probabile pentru NSIP15
DIAGNOSTICUL DE PNEUMOPATIE INTERSTIȚIALĂ DIFUZĂ ASOCIATĂ SARCOIDOZEI
Ghidurile recomandă ca diagnosticul sarcoidozei să implice următoarele instrumente de diagnostic:18

Evaluarea pacientului

Screening histologic și imunologic

Radiografia toracică

Scanarea CT
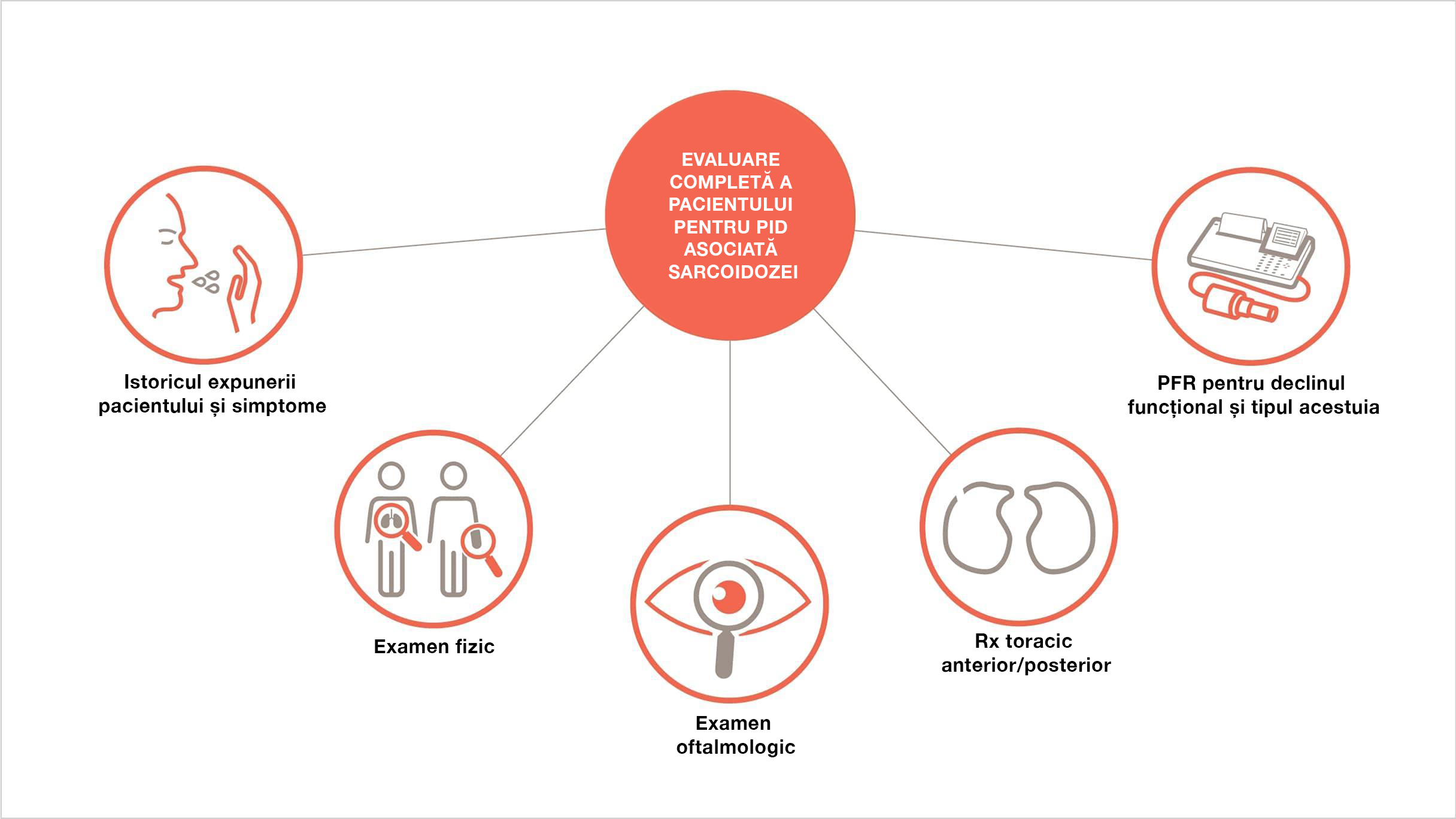
O evaluare completă a pacientului pentru pneumopatia interstițială difuză asociată sarcoidozei ar trebui să includă:18
Scanările CT ale pacienților cu pneumopatie interstițială asociată sarcoidozei arată extinderea și tipul de fibroză care variază de la pacient la pacient, dar se manifestă de obicei ca distorsiuni bronșice (marcate de bronșiectazii de tracțiune și angularea căilor respiratorii), cicatrici liniare și aspect de fagure de miere.19
Procentul de pacienți cu pneumopatie interstițială difuză asociată sarcoidozei care prezintă modificări radiologice specifice pe HRCT (n=80)19
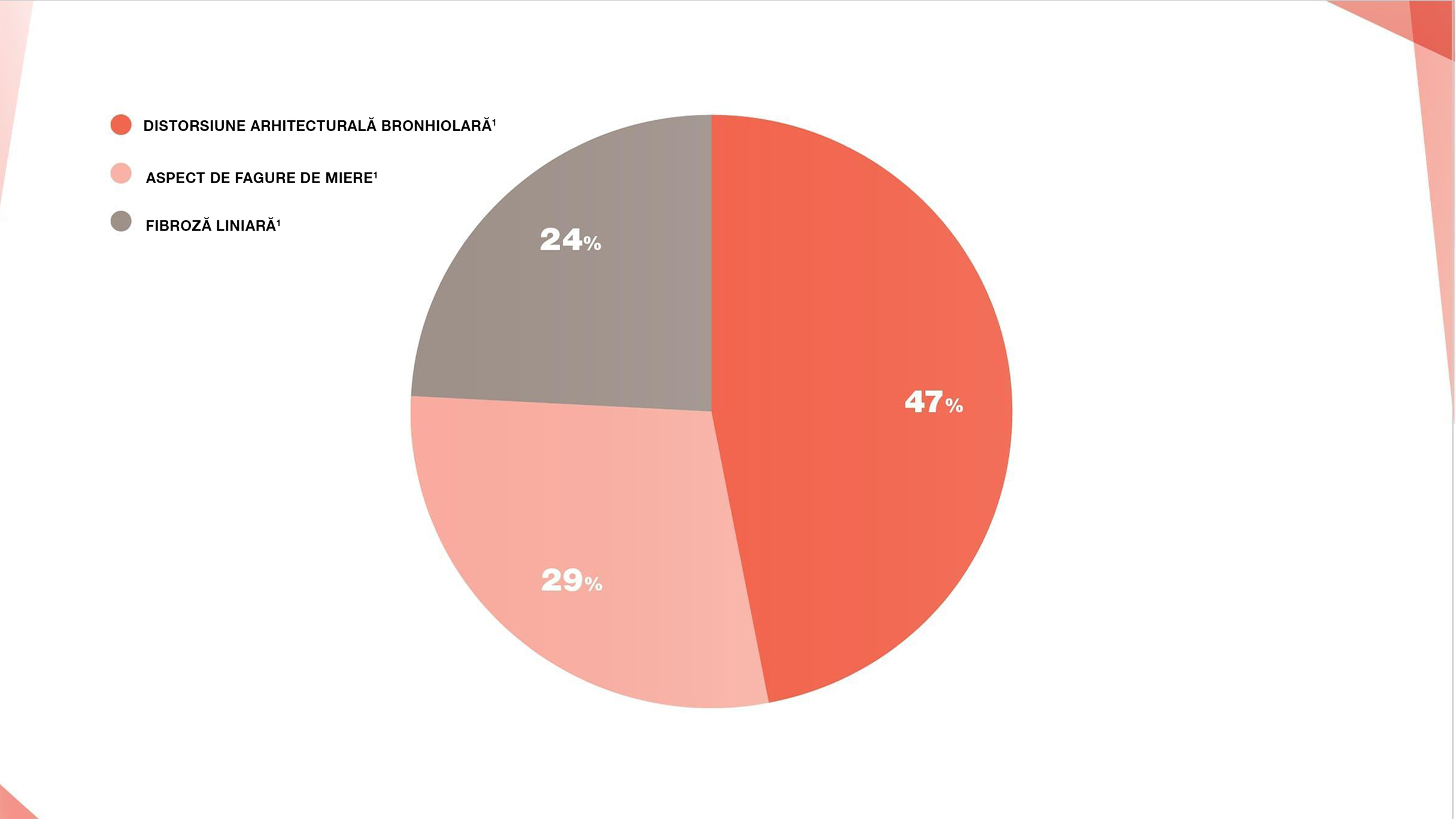
În cazul în care combinația dintre constatările clinice și imagistică nu este suficientă pentru diagnostic, pot fi necesare proceduri de diagnostic mai invazive pentru pneumopatia interstițială difuză asociată sarcoidozei, cum ar fi BAL.7
DIAGNOSTICUL PNEUMONITEI DE HIPERSENSIBILITATE (PH)
În primul rând, istoricul expunerii pacientului trebuie examinat amănunțit20
Ce factori de risc pentru a dezvolta PH, legați de expunere, puteți identifica?
Pacienții cu PH fibrozantă prezintă în mod specific reticulații, bronșiectazii de tracțiune și pierderea volumului pulmonar, cu sau fără aspect de fagure de miere pe HRCT20
- PH subacută poate fi de obicei identificată pe HRCT drept opacități cu aspect de sticlă mată alături de prezența nodulilor centrilobulari, slab definiți20
- Imagistica HRCT efectuată în expir poate fi utilă în diagnosticarea cPH7
La auscultația toracică pot fi auzite raluri de tip ”scârțâit” specifice fibrozei7
Biopsia chirurgicală toracică poate fi necesară în acele cazuri unde nu se poate identifica expunerea cu ajutorul aspectului HRCT de tip UIP care este mai puțin sugestiv pentru PH21
În cazul în care combinația dintre modificările clinice și imagistice nu este suficientă pentru diagnostic, proceduri diagnostice mai invazive pot fi necesare pentru diagnosticul PH, cum ar fi BAL7
Odată pus diagnosticul, cum puteți comunica această veste pacienților dvs. cu PID cu fenotip fibrozant progresiv?
A da o veste proastă pacienților este o sarcină de comunicare dificilă și complexă. În seria noastră de filme documentare, profesorul Walter Baile, psihiatru și co-fondator al modelului SPIKES, ne prezintă prin abordarea sa practică despre cum să structuram conversațiile dificile.
CUM SĂ COMUNICĂM O VESTE PROASTĂ
Capitolul 1 – Provocarea de a comunica vești negative
Profesorul Walter Baile prezintă provocările pe care le implică comunicarea veștilor proaste și ceea ce putem învăța din experiența în oncologie.
Odată ce ați ajuns la un diagnostic, cum ar trebui să vă gestionați pacientul dvs. cu PID cu fenotip fibrozant progresiv?

Factorii de risc pentru progresie
Monitorizare precoce și regulată

Intervenția în cazul PID
ALAT, Societatea Toracică Latino-Americană; ATS, Societatea Toracică Americană; BAL, lavaj bronhoalveolar; PHc, pneumonită cronică de hipersensibilitate; CT, tomografie computerizată; BTC, boala țesutului conjunctiv;PID-BTC, pneumopatie interstițială difuză asociată bolii țesutului conjunctiv; DIP, pneumonie interstițială descuamativă; ERS, Societatea Europeană de Respirație; HP, pneumonită de hipersensibilitate; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză; PIINS, pneumonie interstițială nespecifică idiopatică; FPI, fibroză pulmonară idiopatică; JRS, Societatea Respiratorie Japoneză; MDD, discuție multidisciplinară; MDT, echipă multidisciplinară; NSIP, pneumonie interstițială nespecifică; OP, organizarea pneumoniei; , pneumopatie interstițială difuză inclasificabilă; UIP, pneumopatie interstițială uzuală.
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Wong AW, Ryerson C, Guler S. Progression of fibrosing interstitial lung disease. Respir Res. 2020:29;21(1):32.
- Raghu G, Remy-Jardin M, Myers JL, et al; on behalf of the ATS/ERS/JRS/ALAT. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2018;198(5):e44–e68.
- De Sadeleer LJ, Meert C, Yserbyt J, et al. Diagnostic ability of a dynamic multidisciplinary discussion in interstitial lung diseases: A retrospective observational study of 938 cases. Chest. 2018;153(6):1416–1423.
- Antoniou KM, Margaritopoulos GA, Tomassetti S, Bonella F, Costabel U, Poletti V. Interstitial lung disease. Eur Respir Rev. 2014;23(131):40–54.
- Holtze C, Flaherty K, Kreuter M, et al. Healthcare utilisation and costs in the diagnosis and treatment of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180078.
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
- Chowaniec M, Skoczyńska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
- Raghu G, Collard HR, Egan JJ, et al; on behalf of the ATS/ERS/JRS/ALAT Committee on Idiopathic Pulmonary Fibrosis. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788–824.
- Martinez FJ, Chisholm A, Collard HR, et al. The diagnosis of idiopathic pulmonary fibrosis: current and future approaches. Lancet Respir Med. 2017;5(1):61–71.
- Molina-Molina M, Aburto M, Acosta O, et al. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
- Walsh SLF, Wells AU, Desai SR, et al. Multicentre evaluation of multidisciplinary team meeting agreement on diagnosis in diff use parenchymal lung disease: a case-cohort study. Lancet Respir Med. 2016;4:557-565.
- Jo HE, Glaspole IN, Levin KC, et al. Clinical impact of the interstitial lung disease multidisciplinary service. Respirology. 2016;21(8):1438–1444.
- Tomassetti S, Ryu JH, Piciucchi, et al. Nonspecific Interstitial Pneumonia: What Is the Optimal Approach to Management? Semin Respir Crit Care Med. 2016;37:378–394.
- Travis WD, Hunninghake G, King Jr TE, et al. Idiopathic nonspecific interstitial pneumonia: report of an American Thoracic Society project. Am J Respir Care Med. 2008;177:1338–1347.
- Mueller-Mang C, Grosse C, Schmid K, et al. What Every Radiologist Should Know about Idiopathic Interstitial Pneumonias. Radiographics. 2007;27:595–615..
- Lynch DA, Travis WD, Müller NL. Idiopathic interstitial pneumonias: CT features. Radiology. 2005;236:10–21.
- American Thoracic Society. Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG) adopted by the ATS Board of Directors and by the ERS Executive Committee, February 1999. Am J Respir Med. 1999;160:736–755.
- Abehsera M. Sarcoidosis with pulmonary fibrosis: CT patterns and correlation with pulmonary function. AJR Am J Roentgenol. 2000;174:1751–1757.
- Kouranos V, Jacob J, Nicholson A, et al. Fibrotic Hypersensitivity Pneumonitis: Key Issues in Diagnosis and Management. J Clin Med. 2017;6:62.
- Morisset J, Johannson KA, Jones KD, et al. Identification of Diagnostic Criteria for Chronic Hypersensitivity Pneumonitis. An International Modified Delphi Survey. Am J Resp Crit Care Med. 2018;197:1036–1044.
- Wijsenbeek MS, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019:1–10.
- Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
- Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
- Maher TM, Molina-Molina M, Russell AM, et al. Unmet needs in the treatment of idiopathic pulmonary fibrosis-insights from patient chart review in five European countries. BMC Pulm Med. 2017;17(1):124.
- Robalo-Cordeiro C, Campos P, Carvalho L, et al. Idiopathic pulmonary fibrosis in the era of antifibrotic therapy: Searching for new opportunities grounded in evidence. Rev Port Pneumol. 2017;23(5):287–293.
