Intervențiile în cazul PID
Tratamentul precoce este esențial în cazul PID cu fenotip fibrozant progresiv FPI, PID-ScS și non-FPI pentru a ajuta la îmbunătățirea rezultatelor obținute de pacienți1–5

Fenotipul fibrozant progresiv se caracterizează prin extinderea crescută a fibrozei, agravarea simptomatologiei respiratorii și declinul funcției pulmonare.6–9
FPI NU AȘTEAPTĂ
FPI este considerată cea mai tipică PID cu fenotip fibrozant progresiv.8 Când un pacient cu FPI rămâne fără tratament adecvat, acesta va continua să-și piardă funcția pulmonară și rămâne expus riscului unei exacerbări acute a FPI.10–13

Nu există timp pentru a sta și a aștepta în cazul FPI1,13
O reducere de 5%-10% a CVF pe parcursul a 6 luni crește semnificativ riscul de deces al pacientului14,15
O reducere a CVF de ≥10% estimată pe parcursul a 24 de săptămâni crește semnificativ riscul de deces în următoarele 24 de săptămâni al unui pacient cu FPI16
Cu toate acestea, absența declinului CVF nu înseamnă absența progresiei subiacente în FPI.16–18 Apariția stabilității CVF la momentul inițial nu indică o stare stabilă și a FPI.16–18
TRATAMENTUL PRECOCE ESTE ESENȚIAL ÎN FPI ȘI AR PUTEA IMPACTA POZITIV PROGRESIA ȘI ÎMBUNĂTĂȚI REZULTATE PENTRU PACENȚI1–3
Tratamentul antifibrotic început imediat după diagnostic3 ar putea ajuta la încetinirea progresiei cu cât funcția pulmonară este mai bine păstrată1,13,19

Nu există nicio garanție că o CVF bine conservată la momentul inițial va fi menținută, așa că tratamentul ar trebui să înceapă imediat după diagnostic pentru a ajuta la păstrarea cât mai multor funcții pulmonare16,18

Tratamentul antifibrotic început imediat după diagnostic poate reduce semnificativ scăderea CVF în următoarele 12 luni20
Subliniați obiectivele tratamentului pacienților cu FPI, cum ar fi păstrarea funcției pulmonare și creșterea speranței de viață, pentru a-i ajuta să ia o decizie informată pentru inițierea tratamentului.21*
Educarea pacienților cu FPI cu privire la modul în care ajustarea dozei poate gestiona posibilele efecte secundare ale tratamentului antifibrotic poate ajuta, de asemenea, la asigurarea începerii tratamentului și la prelungirea beneficiilor tratamentului18
Care sunt beneficiile semnificative legate de supraviețuire în practica clinică pentru pacienții cu FPI tratați cu antifibrotice?*
Datele din practica clinică* arată o îmbunătățire semnificativă a supraviețuirii pacienților cu FPI care iau tratament antifibrotic comparativ cu cei care nu iau tratament antifibrotic.22,23
Registrul european FPI: îmbunătățirea semnificativă a supraviețuirii pacienților cu FPI tratați cu antifibrotice comparativ cu pacienții netratați22†
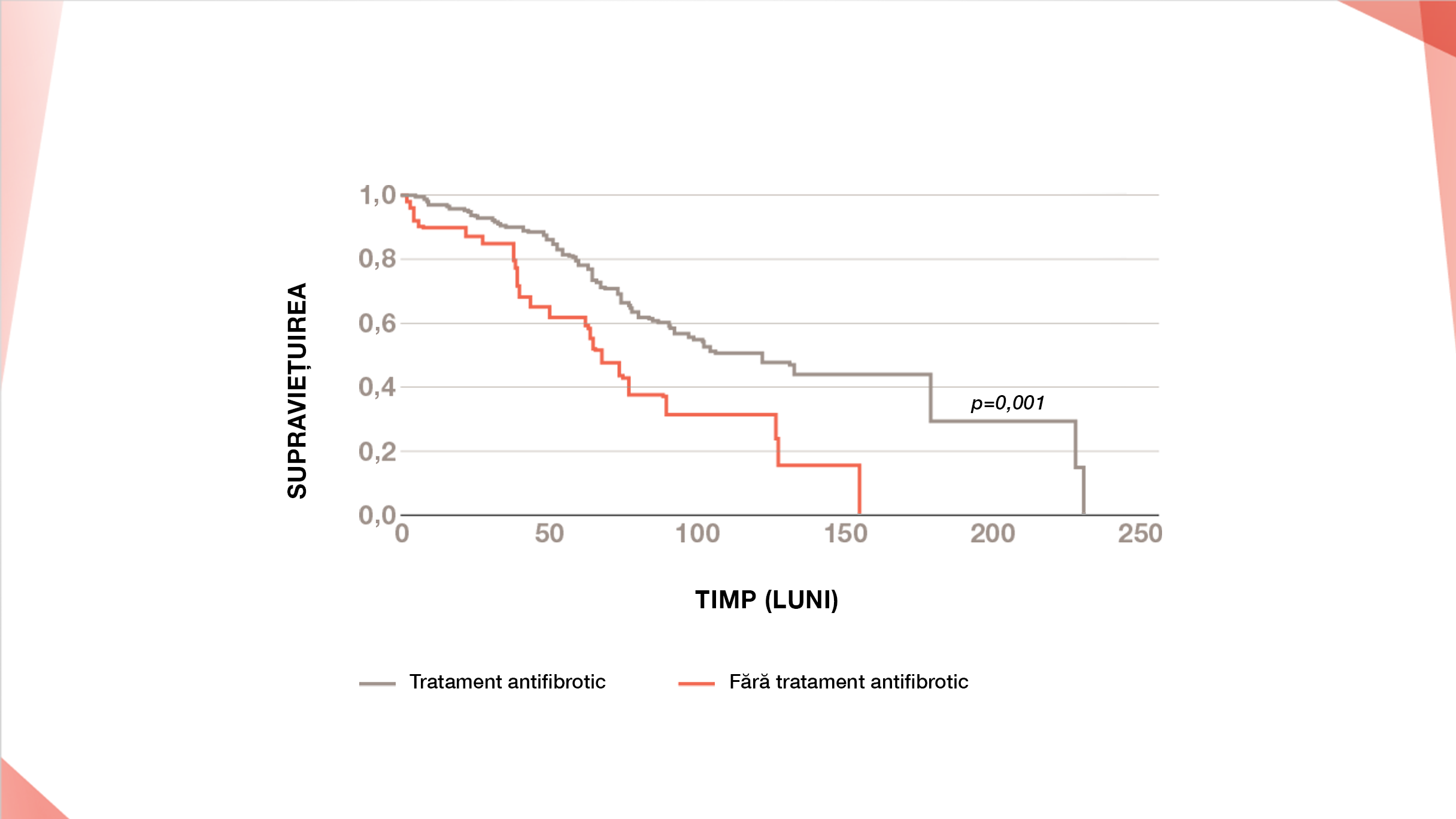
*Curbele Kaplan-Meier pentru supraviețuirea cumulativă, bazate pe date privind rezultatele definitive (statusul de supraviețuire cunoscut cu siguranță la sfârșitul anului 2016) și pe datele ultimei vizite.22
† O diferență semnificativă statistic în ceea ce privește supraviețuirea a fost întâlnită între pacienții care au primit tratament antifibrotic și cei care nu au primit tratament antifibrotic, cu un nivel de semnificație p=0,001.
Registrul australian FPI: îmbunătățire semnificativă* a supraviețuirii pacienților cu FPI tratați cu antifibrotice față de pacienții netratați23†
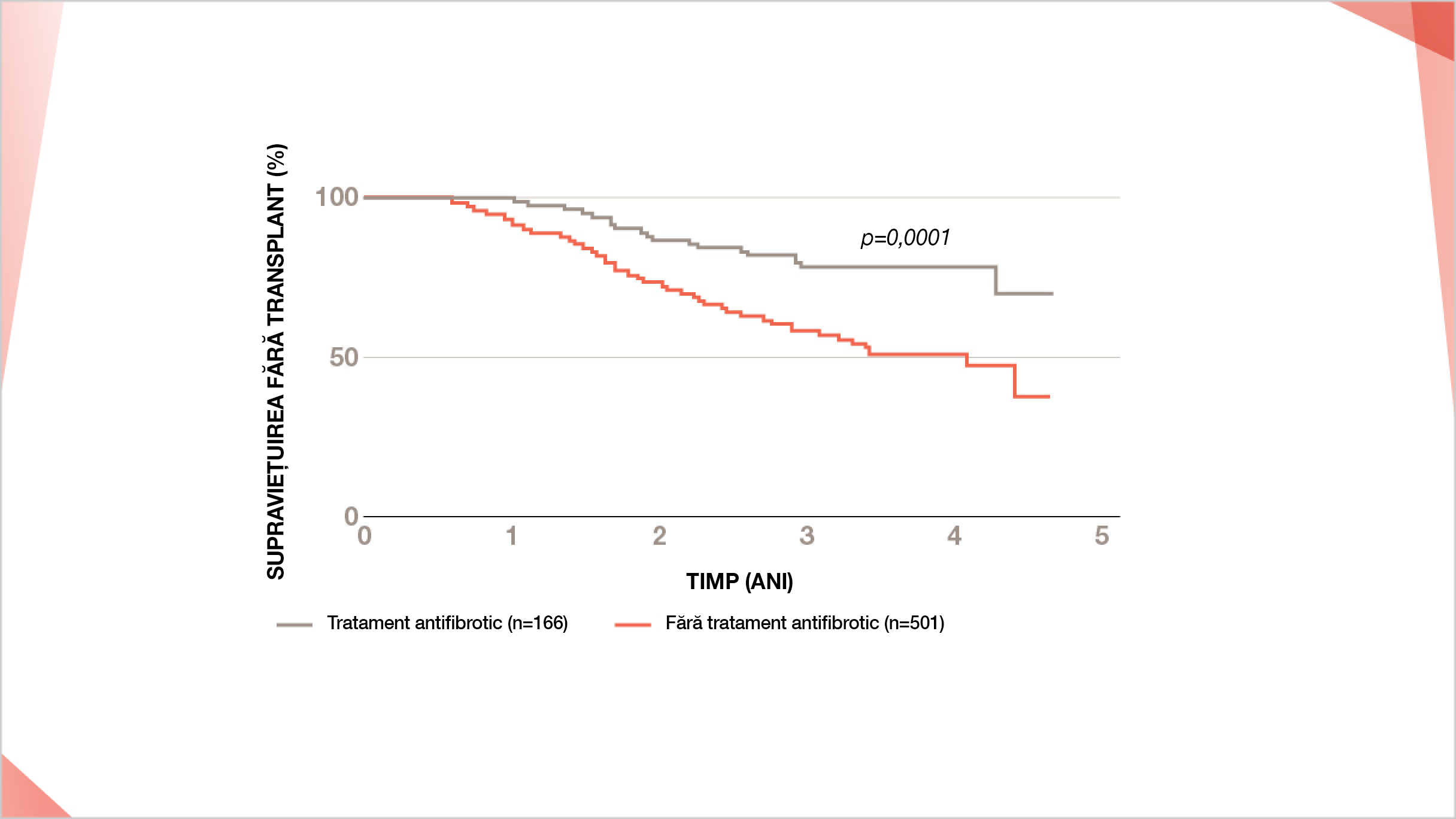
* HR 0.38, 95% CI 0,24-0,59, p<0.001
† Pacienții care au primit transplant pulmonar au fost excluși din analiză. Au fost efectuate analize Kaplan-Meier și Cox univariate pentru a calcula mortalitatea anuală.23
Registrul finlandez FPI: îmbunătățire semnificativă a supraviețuirii pacienților cu FPI tratați cu antifibrotice timp de > 6 luni față de pacienții netratați24*†
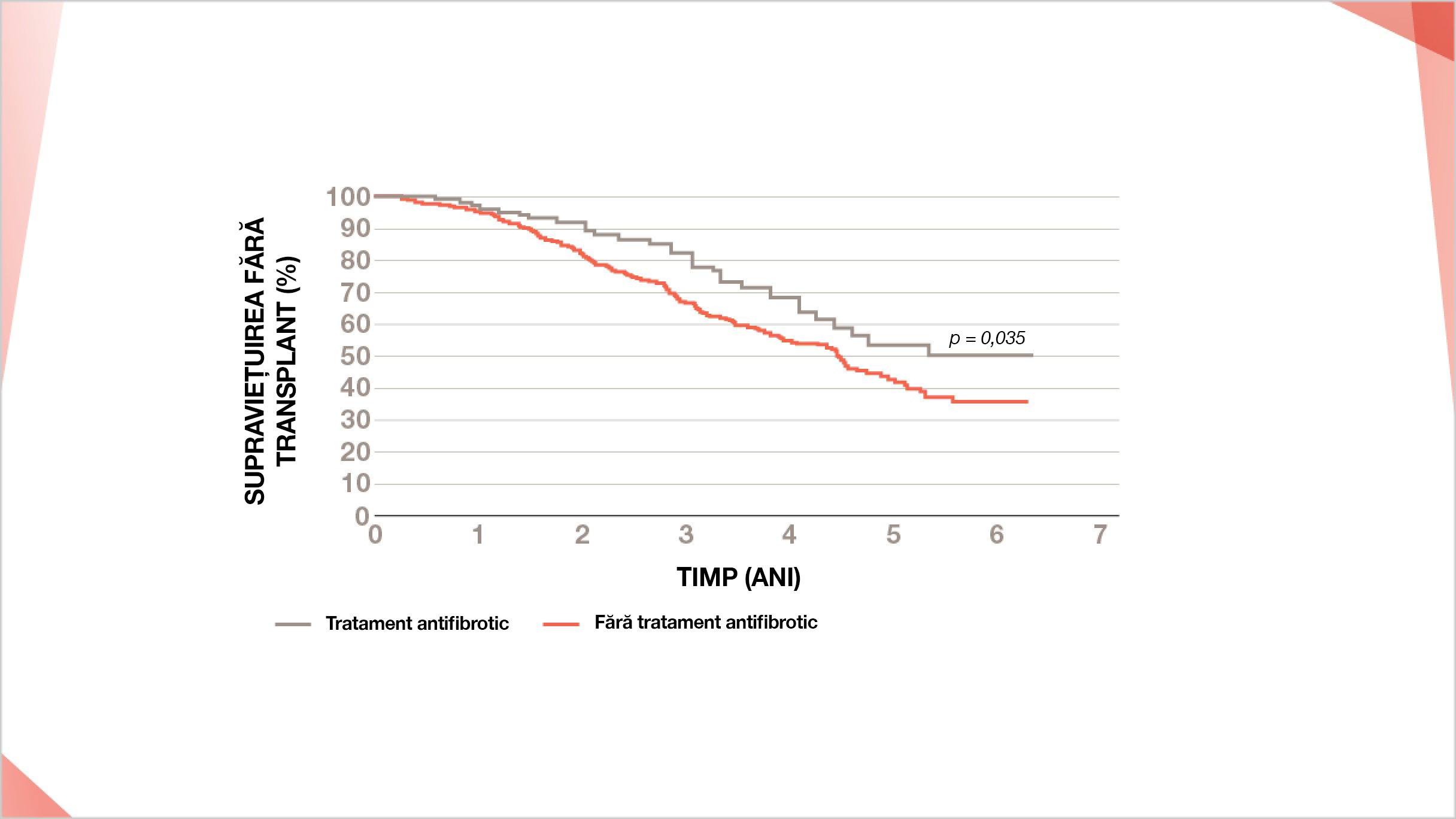
* Din registrul FPI finlandez (2011–2015) (n=453) coordonat de Jaana Kaunisto.
† Supraviețuirea fără transplant a fost măsurată de la diagnostic până la deces sau până la data transplantului. Supraviețuirea a fost evaluată folosind metoda Kaplan-Meier și diferențele dintre curbele de supraviețuire au fost evaluate folosind testul log-rank. Asociațiile variabilelor cu supraviețuirea au fost analizate utilizând analiza de regresie Cox univariată.
Registrul INSIGHTS-FPI: îmbunătățire semnificativă* a supraviețuirii pacienților cu FPI tratați cu antifibrotice față de pacienții netratați25†
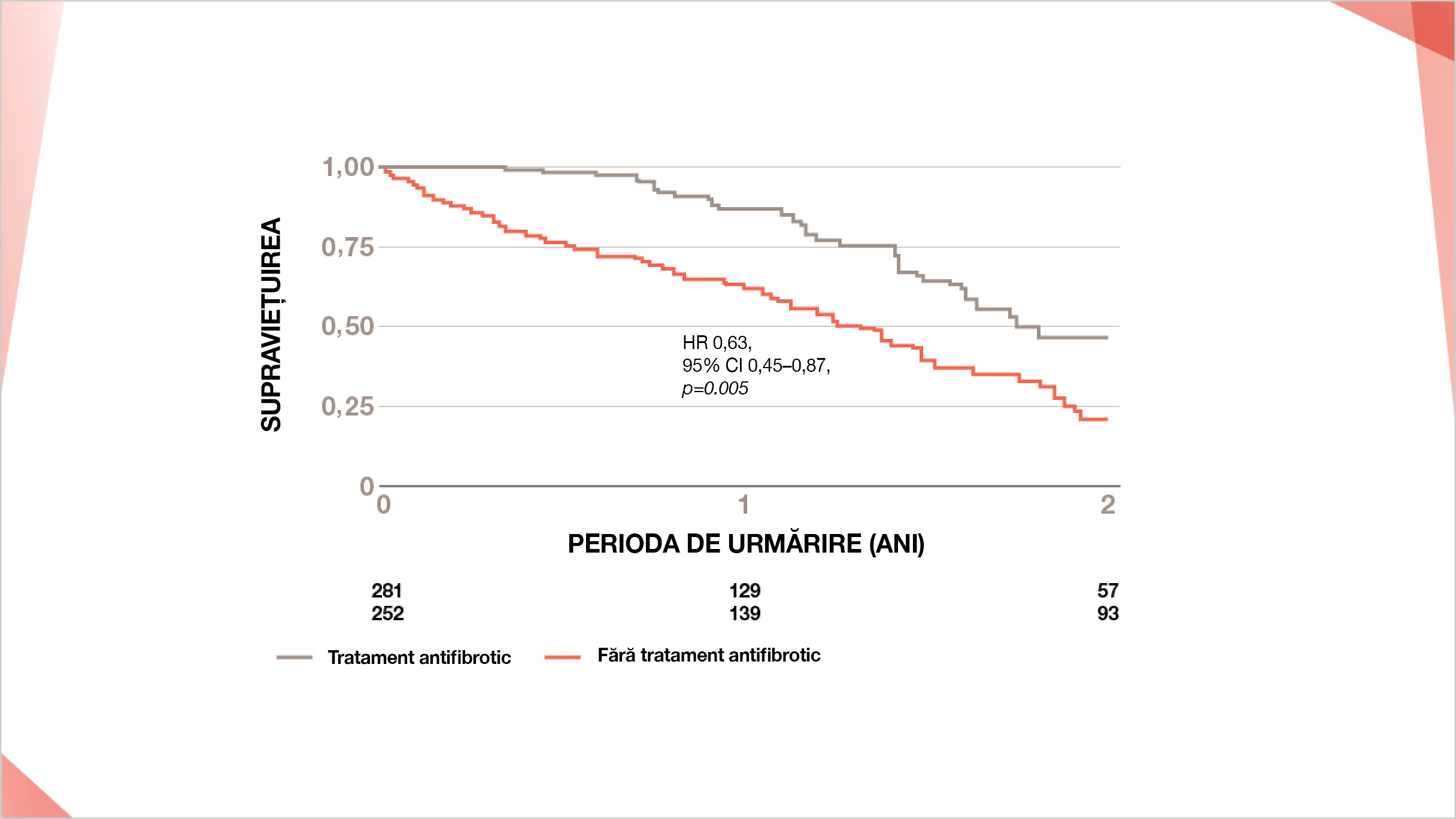
* HR 0,63, 95% CI 0,45–0,87, p=0.005
† Din registrul INSIGHTS-FPI prezentat de prof. Jürgen Behr.
MANAGEMENTUL PID NON-FPI
Tratamentul PID cronice cu fenotip fibrozant progresiv non-FPI nu trebuie să aștepte5,7,26,27
Recomandări consensuale pentru diagnosticul și managementul PID cronice non-FPI cu fenotip fibrozant progresiv28
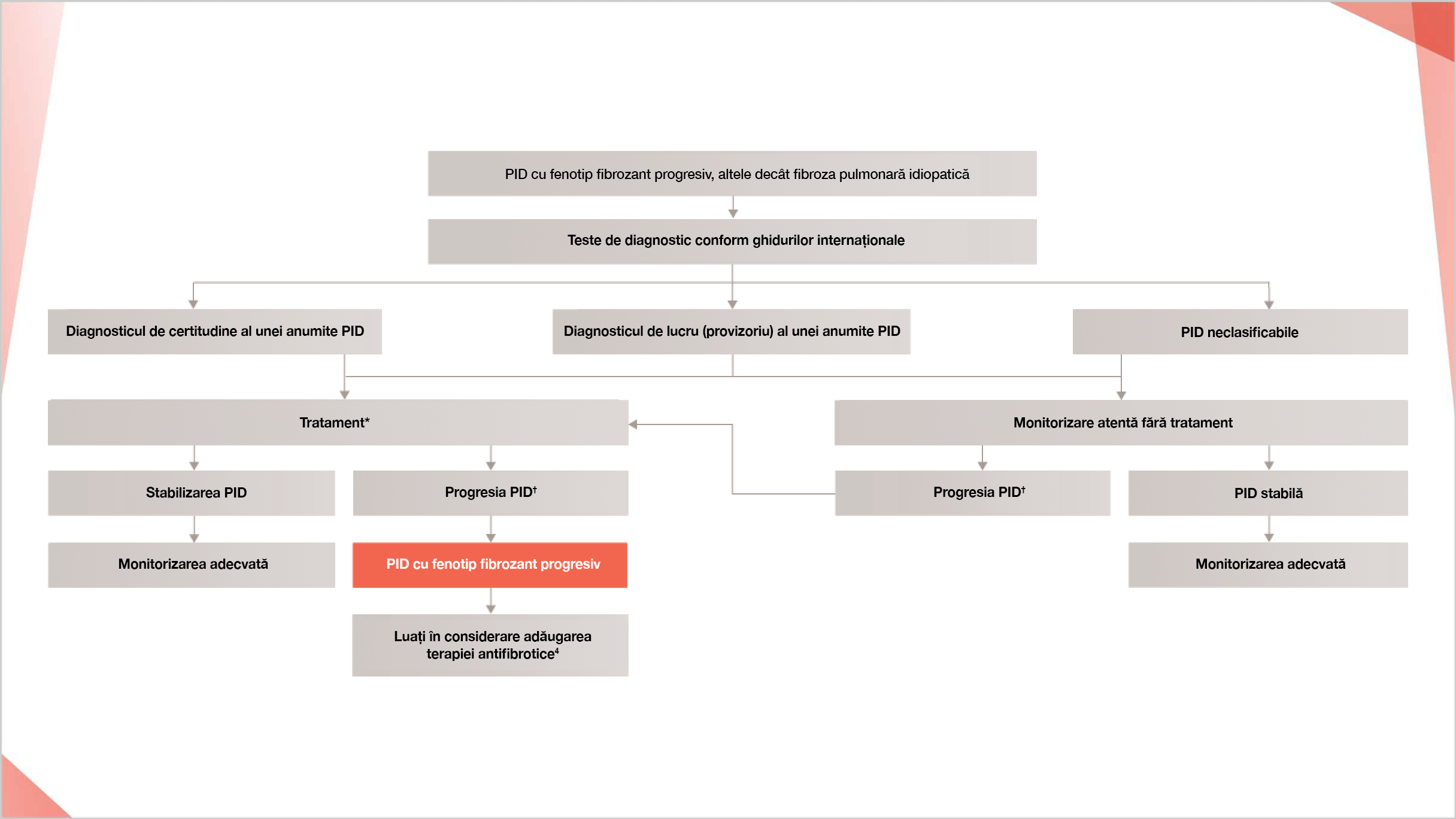
* Terapia standard specifică fiecărei entități PID.
† Definiția progresiei PID este descrisă de: George PM, et al. Lancet Respir Med. 2020;8:925–934.
‡ Sub rezerva autorizării de punere pe piață în fiecare țară.
Adaptat după: George PM, et al. Lancet Respir Med. 2020;8:925–954.
Măsurile potențiale care pot ajuta la prevenirea exacerbării acute a PID cu fenotip fibrozant progresiv includ:29
Vaccinarea anti-pneumococică și anti-influenza
Spălarea mâinilor și evitarea contactului cu persoanele bolnave
Evitarea iritanţilor şi poluanţilor din aer
Strategii pentru a minimiza leziunile pulmonare induse de ventilatoarele mecanice
PENTRU MANAGEMENTUL ANUMITOR PID EXISTĂ RECOMANDĂRI DE TRATAMENT ATÂT ÎN CEEA CE PRIVEȘTE ABORDAREA FARMACOLOGICĂ, CÂT ȘI CEA NON-FARMACOLOGICĂ
PNEUMONITA DE HIPERSENSIBILITATE (PH): RECOMANDĂRI DE MANAGEMENT TERAPEUTIC
Identificarea și îndepărtarea antigenului responsabil pentru răspunsul hipersensibil ar trebui să fie întotdeauna primul pas în managementul terapeutic al PH30
În rândul pacienților cu PH, determinarea antigenului iritant este importantă pentru consilierea și managementul pacientului31
Terapia farmacologică poate fi adecvată, dar este important să se reevalueze răspunsul la tratament la 3 luni, deoarece pacienții cu PH la care funcția pulmonară nu s-a stabilizat în acest stadiu prezintă un risc crescut de deces28,30
Când o anumită terapie farmacologică se administrează mai mult de 3-6 luni fără succes, trebuie luate în considerare terapii alternative30
PNEUMOPATIE INTERSTIȚIALĂ IDIOPATICĂ NESPECIFICĂ (PIINS) RECOMANDĂRI DE MANAGEMENT TERAPEUTIC:
Similar pacienților dumneavoastră cu PH, terapia farmacologică poate fi adecvată, dar este important să reevaluați răspunsul la tratament la 3 luni, deoarece pacienții cu NSIP la care funcția pulmonară nu s-a stabilizat în acest stadiu prezintă un risc crescut de deces28
Terapia de suport pentru pacienții cu PIINS include oxigenenoterapia și reabilitarea pulmonară32
Transplantul pulmonar trebuie recomandat în cazul pacienților cu PIINS progresiv32
RECOMANDĂRI PENTRU MANAGEMENTUL PNEUMOPATIEI INTERSTIȚIALE DIFUZE ASOCIATE SARCOIDOZEI:
Tratamentul trebuie administrat pacienţilor care îndeplinesc următoarele criterii:33
Agravarea simptomatologiei
Limitarea activităților
Declin marcat, anormal al funcției pulmonare
Modificări îngrijorătoare ale radiografiei toracice
CONSIDERAȚII PRIVIND MANAGEMENTUL TERAPEUTIC AL PNEUMOPATIEI INTERSTIȚIALE DIFUZE NECLASIFICABILE (NPID):
Terapiile non-farmacologice pentru PID cu fenotip fibrozant progresiv care ar trebui luate în considerare în mod obișnuit includ:34
Stoparea fumatului
Evitarea expunerilor potențial dăunătoare
Vaccinarea anti-pneumococică și anti-influenza
Reabilitarea pulmonară
Oxigenoterapie pe termen lung
Managementul comorbidităților
PNEUMOPATIA INTERSTIȚIALĂ DIFUZĂ ASOCIATĂ SCLEROZEI SISTEMICE (PID-ScS) CONSIDERAȚII DE MANAGEMENT TERAPEUTIC:
Inițierea tratamentului la pacienții cu PID-ScS ar trebui să vizeze prevenirea progresiei pentru a evita afectarea pulmonară ireversibilă4,35,36
Practica actuală de tratament a pacienților cu PID-ScS odată ce a avut loc progresia este sub-optimală4
Acest lucru poate duce la pierderea oportunităților de a trata pacienții a căror boală progresează, deoarece acești pacienți ar putea fi stabili în timpul perioadei de monitorizare
Ce altceva putem face pentru a gestiona PID-ScS?
CONSIDERAȚII PRIVIND MANAGEMENTUL TERAPEUTIC AL PNEUMOPATIEI INTERSTIȚIALE DIFUZE ASOCIATE ARTRITEI REUMATOIDE (PID-AR):
Progresia și severitatea PID sunt principalii factori de luat în considerare în luarea deciziilor terapeutice37
Tratamentul poate fi luat în considerare:
-
Indiferent dacă modelul HRCT este UIP sau NSIP
-
Dacă PID este semnificativă clinic (simptome, severitate)
-
Dacă PID este progresivă
Ce alte considerente de management terapeutic ar trebui să luați în calcul?

Acordarea îngrijirilor paliative/suportive

Echipe multidisciplinare

Cazuri de pacienți cu PID pentru evaluare, diagnostic și monitorizare
Note
-
*
Inițierea tratamentului se face cu rezerva tratamentului disponibil aprobat de țara locală.
CI, interval de încredere; CVF, capacitate vitală forțată; HP, pneumonită de hipersensibilitate; HR, hazard ratio; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză; PIINS, pneumonie interstițială nespecifică idiopatică; FPI, fibroză pulmonară idiopatică; NSIP, pneumonie interstițială nespecifică; PID-RA, pneumopatie interstițială difuză asociată artritei reumatoide; PID-ScS, pneumopatie interstițială difuză asociată sclerozei sistemice; NPID, pneumopatie interstițială difuză inclasificabilă; UIP, pneumopatie interstițială uzuală.
- Maher TM, Molina-Molina M, Russell AM, et al. Unmet needs in the treatment of idiopathic pulmonary fibrosis-insights from patient chart review in five European countries. BMC Pulm Med. 2017;17(1):124.
- Molina-Molina M, Aburto M, Acosta O, et al. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
- Robalo-Cordeiro C, Campos P, Carvalho L, et al. Idiopathic pulmonary fibrosis in the era of antifibrotic therapy: Searching for new opportunities grounded in evidence. Rev Port Pneumol. 2017;23(5):287–293.
- Distler O, Volkmann ER, Hoffmann-Vold AM, et al. Current and future perspectives on management of systemic sclerosis-associated interstitial lung disease. Expert Rev Clin Immunol. 2019;15:1009–1017.
- Wijsenbeek MS, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019:1–10.
- Flaherty KR, et al. Design of the PF-ILD trial: a double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res. 2017;4(1):e000212.
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
- Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
- Ryerson C, Cottin V, Brown K, Collard H. Acute exacerbation of idiopathic pulmonary fibrosis: shifting the paradigm. Eur Respir J. 2015;46(2):512–520.
- van Manen MJ, Geelhoed JJ, Tak NC, Wijsenbeek MS. Optimizing quality of life in patients with idiopathic pulmonary fibrosis. Ther Adv Respir Dis. 2017;11(3):157–169.
- Hambly N, Cox G, Kolb M. Acute exacerbations of idiopathic pulmonary fibrosis: tough to define; tougher to manage. Eur Respir J. 2017;49(5):1700811.
- Torrisi SE, Pavone M, Vancheri A, Vancheri C. When to start and when to stop antifibrotic therapies. Eur Respir Rev. 2017;26(145):170053.
- Cosgrove GP, Bianchi P, Danese S, Lederer DJ. Barriers to timely diagnosis of interstitial lung disease in the real world: the INTENSITY survey. BMC Pulm Med. 2018;18(1):9.
- Ley B, Collard HR, King TE Jr. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2011;183(4):431–440.
- Richeldi L, Crestani B, Azuma A, et al. Outcomes following decline in forced vital capacity in patients with idiopathic pulmonary fibrosis: Results from the INPULSIS and INPULSIS-ON trials of nintedanib. Resp Med. 2019;156:20-25.
- Maher TM, Stowasser S, Nishioka Y, et al. Biomarkers of extracellular matrix turnover in patients with idiopathic pulmonary fibrosis given nintedanib (INMARK study): a randomised, placebo-controlled study. Lancet Respir Med. 2019;S2213-2600(19)30255-3.
- Maher TM, Strek ME. Antifibrotic therapy for idiopathic pulmonary fibrosis: time to treat. Respir Res. 2019;20:205.
- Kolb M, Richeldi L, Behr J, et al. Nintedanib in patients with idiopathic pulmonary fibrosis and preserved lung volume. Thorax. 2017;72:340–346.
- Poletti V, Vancheri C, Albera C. Clinical course of IPF in Italian patients during 12 months of observation: results from the FIBRONET observational study. Poster presented at the European Respiratory Society International Congress, 28 September – 2 October, 2019, Madrid, Spain.
- Moua T, Ryu JH. Obstacles to early treatment of idiopathic pulmonary fibrosis: current perspectives. Ther Clin Risk Manag. 2019;15:73–81.
- Guenther A, Krauss E, Tello S, et al. The European IPF registry (eurIPFreg): baseline characteristics and survival of patients with idiopathic pulmonary fibrosis. Respir Res. 2018;19(1):141.
- Jo HE, Glaspole I, Grainge C, et al. Baseline characteristics of idiopathic pulmonary fibrosis: analysis from the Australian Idiopathic Pulmonary Fibrosis Registry. Eur Respir J. 2017;49:1601592.
- Kaunisto J, Salomaa E, Hodgson U. Demographics and survival of patients with idiopathic pulmonary fibrosis in the Finnish IPF registry. ERJ Open Res. 2019;5:00170-2018.
- Behr J, Prasse A, Wirtz H, et al. Survival and course of lung function in the presence or absence of antifibrotic treatment in patients with idiopathic pulmonary fibrosis: long-term results of the INSIGHTS-IPF registry. Eur Respir J. 2020; in press (https://doi.org/10.1183/13993003.02279-2019).
- Geerts S, Wuyts W, De Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Diffuse Lung Dis. 2017;34(4):326–335.
- Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10(12):728–739.
- George PM, Spagnolo P, Kreuter M, et al. Progressive fibrosing interstitial lung disease: clinical uncertainties, consensus recommendations, and research priorities. Lancet Respir Med. 2020;8:925–954.
- Kolb M, Bondue B, Pesci A, et al. Acute exacerbations of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180071.
- Varone F, Iovene B, Sgalla G, et al. Fibrotic Hypersensitivity Pneumonitis: Diagnosis and Management. Lung. 2020;https://doi.org/10.1007/s00408-020-00360-3.
- Fernandez Perez ER, Swigris JJ, Forssen AV, et al. Identifying an Inciting Antigen Is Associated With Improved Survival in Patients With Chronic Hypersensitivity Pneumonitis. Chest. 2013;144:1644–1651.
- Tomassetti S, et al. Semin Respir Crit Care Med. 2016;37:378–394.
- Ianuzzi MC, Sah BP. Sarcoidosis. Merck Manual Professional Version website. Available at: https://www.merckmanuals.com/professional/pulmonary-disorders/sarcoidosis/sarcoidosis. August 2017. Accessed: November 2020.
- Guler SA, Ryerson CJ. Unclassifiable interstitial lung disease: from phenotyping to possible treatments. Curr Opin Pulm Med. 2018;24:461–468.
- Hoffmann-Vold AM, Allanore Y, Alves M, et al. Progressive interstitial lung disease in patients with systemic sclerosis-associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020a;217455.
- Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. The Lancet Rheumatology. 2020b;2: e71–e83.
- Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082. doi: 10.3390/jcm9041082.
- Lake F and Proudman S. Rheumatoid arthritis and lung disease: from mechanisms to a practical approach. Semin Respir Crit Care Med. 2014;35(2):222–238.
- Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
- Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
- Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
- Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
