Monitorizarea progresiei PID
Agravarea simptomatologiei sau scăderea scorurilor PFR poate însemna că fibroza pulmonară a pacientului progresează1

O proporție dintre pacienții cu PID pot dezvolta un fenotip fibrozant progresiv.2–5
Odată ce explicațiile alternative, cum ar fi infecția tractului respirator, au fost excluse și tratate, pacienții cu PID care îndeplinesc următoarele criterii în decurs de 24 de luni, în pofida tratamentului, în practica clinică pot fi considerați ca având fibroză progresivă:6
Scăderea relativă de ≥10% a CVF
Scăderea relativă de ≥5–<10% a CVF și scăderea relativă de ≥15% a DLco
Scăderea relativă de ≥5–<10% a CVF și agravarea simptomelor respiratorii
Scăderea relativă de ≥5–<10% a CVF și extinderea crescută a fibrozei la HRCT
Agravarea simptomatologiei respiratorii și extinderea fibrozei la HRCT
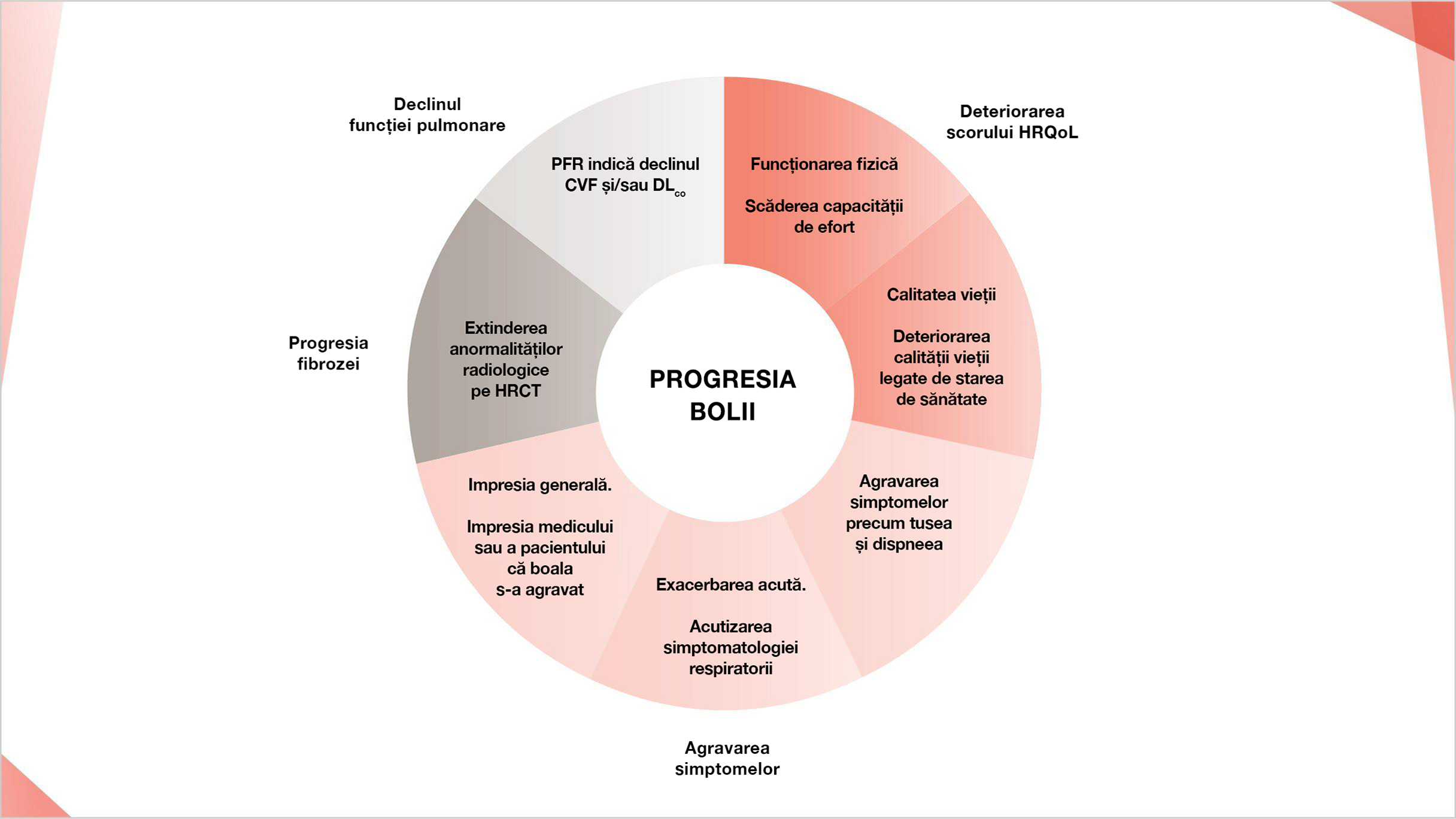
PACIENȚI CU PID CU FENOTIP FIBROZANT PROGRESIV SE CONFRUNTĂ CU UN PROGNOSTIC NEFAVORABIL2
PID cu fenotip fibrozant progresiv are un impact semnificativ asupra pacienților, inclusiv în ceea ce privește mortalitatea precoce:2–5,7

PID poate provoca deteriorarea progresivă a funcției pulmonare, a simptomatologiei respiratorii și a calității vieții3,4,8–11

Dacă PID nu poate fi stabilizată în 6-12 luni, pacienții cu PHc și NSIP vor prezenta scăderea continuă a funcției pulmonare și creșterea mortalității6
PID cu fenotip fibrozant progresiv se caracterizează prin progresia fibrozei pulmonare, agravarea simptomelor, declinul funcției pulmonare și deteriorarea calității vieții legate de starea de sănătate4
Aflați mai multe despre impactul fenotipului fibrozant progresiv
MONITORIZAREA PRECOCE ȘI REGULATĂ A FIBROZEI PULMONARE LA PACIENȚII CU PID ESTE IMPORTANTĂ PENTRU DETECȚIA PRECOCE A FENOTIPULUI FIBROZANT PROGRESIV CÂT MAI CURÂND POSIBIL11,12
Timpul este esențial atunci când se suspicionează PID cu fenotip fibrozant progresiv:3
Diagnosticarea tardivă a fibrozei pulmonare progresive în PID poate fi letală: pacienții au un timp de supraviețuire estimat la 2,5–4 ani după detectarea fibrozei progresive2–3†
Detectarea precoce a pacienților cu PID cu fenotip fibrozant progresiv ar putea influența deciziile de management și consilierea pacientului2
CUM PUTEM SCURTA TIMPUL DINTRE DIAGNOSTICUL PID ȘI DETECȚIA FENOTIPULUI FIBROZANT PROGRESIV LA PACIENȚII DVS.?
Într-un sondaj online efectuat cu medici, s-a estimat că este nevoie de 9-12 luni după apariția fenotipului fibrozant progresiv pentru ca acesta să fie detectat2†
Perioadele de timp estimate dintre simptomele inițiale ale PID și detectarea fenotipului fibrozant progresiv la pacienții cu diferite PID2†
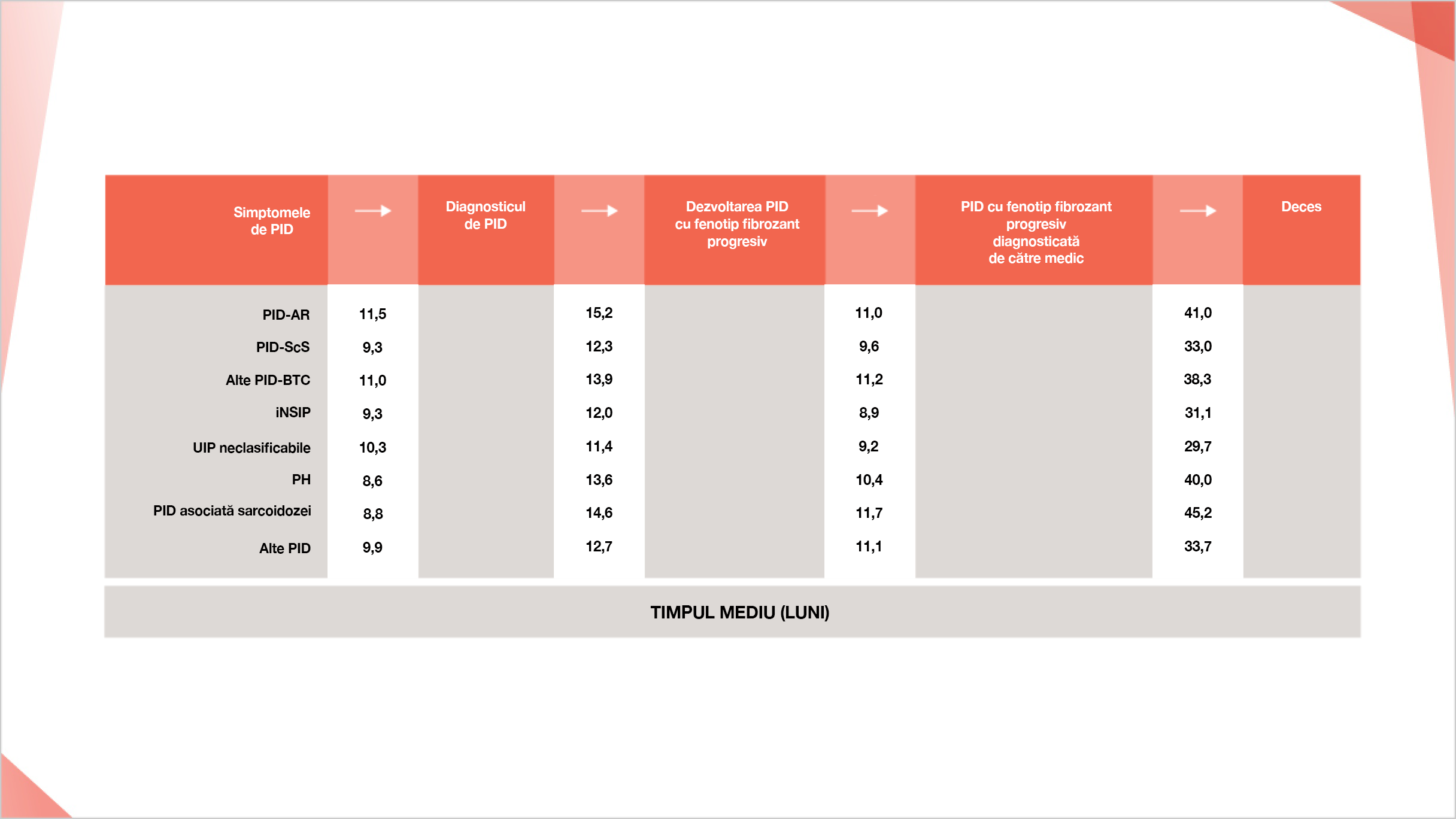
Traseul pacientului cu PID cu fenotip fibrozant progresiv non-FPI, estimată printr-un sondaj online efectuat cu medici.2†
† Estimările privind procentul de pacienți cu PID non-FPI care dezvoltă fibroză progresivă se bazează pe un sondaj online desfășurat pe 486 de medici (243 de pneumologi, 203 de reumatologi și 40 de interniști) din Statele Unite, Japonia, Franța, Germania, Italia, Spania și Marea Britanie.3
Abordarea multidisciplinară este standardul de aur în evaluarea severității PID13
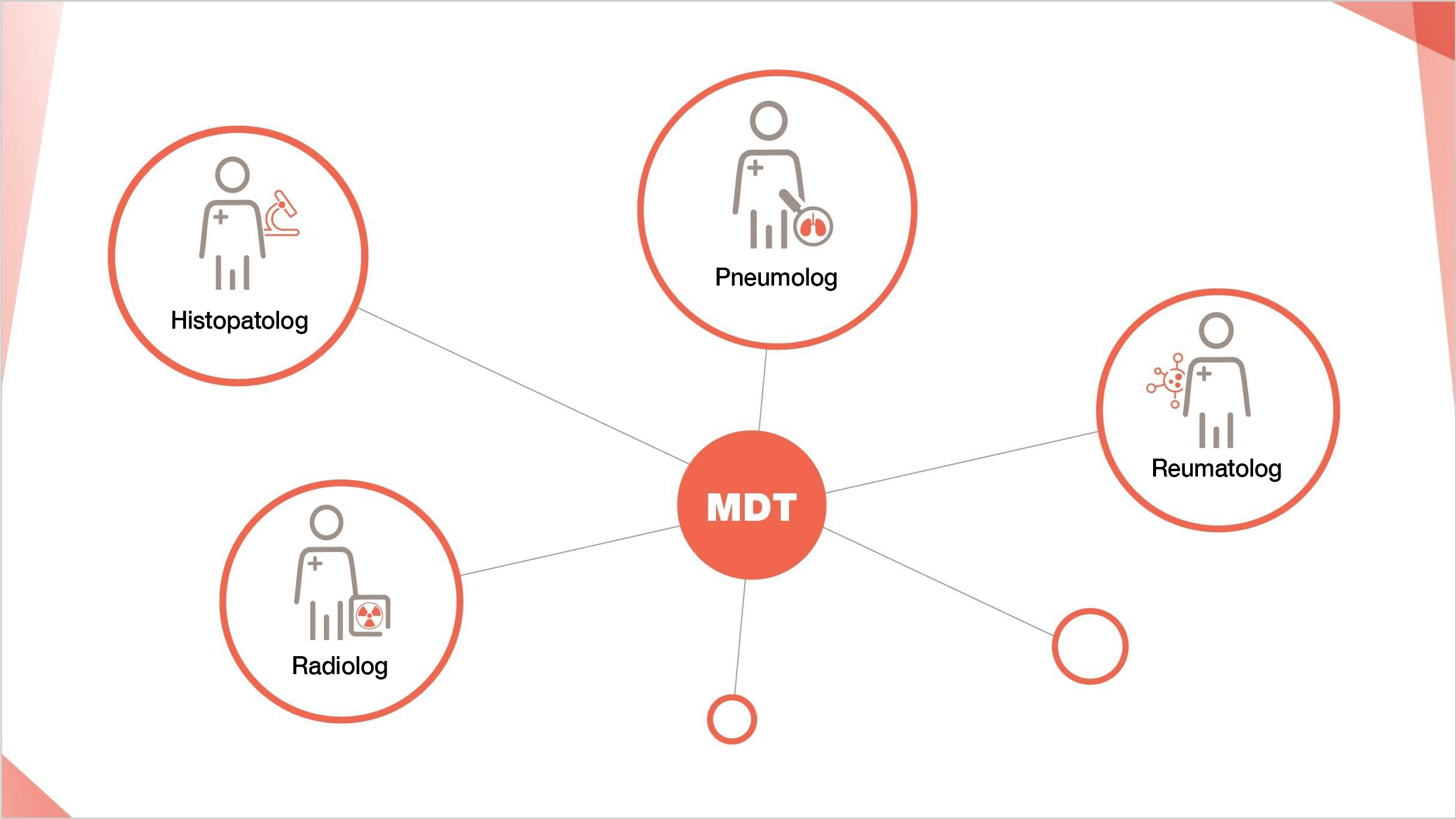
Diagnosticul și monitorizarea PID care pot prezenta un fenotip fibrozant progresiv3
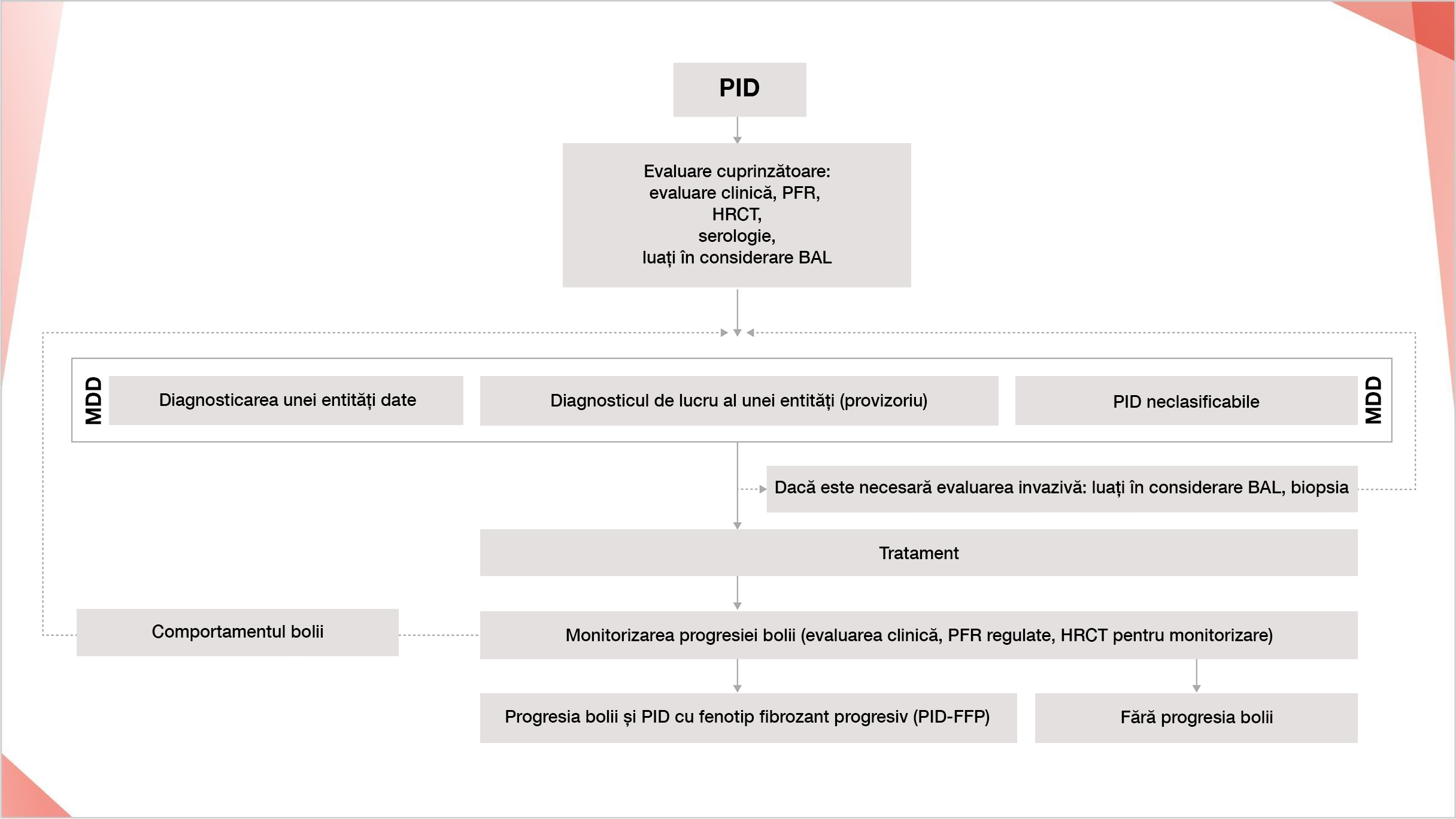
Adaptat după: Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clionical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
MONITORIZAREA PENTRU FENOTIPUL FIBROZANT PROGRESIV CU PFR, HRCT ȘI EVALUAREA SIMPTOMELOR
Agravarea simptomatologiei respiratorii

HRCT

PFR
Monitorizarea progresiei PID folosind PFR:
Deteriorarea PFR ar trebui să declanșeze urgența pentru investigații suplimentare - deoarece fibroza pulmonară are o evoluție imprevizibilă1,14
Scăderea DLco este adesea considerată un semn de PID cu fenotip fibrozant progresiv, în special atunci când este însoțită de o scădere a CVF sau extinderea în timp a dovezilor radiologice de fibroză pe HRCT6
Confirmarea progresiei PID folosind HRCT:
Pentru pacienții aflați la risc de a dezvolta un fenotip fibrozant progresiv, HRCT trebuie evaluat la agravarea fie a rezultatelor PFR, fie a simptomelor respiratorii3,15–17
Alte considerații pentru monitorizarea progresiei PID

Exacerbarea acută a PID poate fi considerată un indicator al progresiei fibrozei, deoarece funcția pulmonară scade ireversibil ca urmare a unei exacerbări acute6

Măsurarea regulată a 6MWD (testul de mers pe jos timp de 6 minute) poate fi utilă în identificarea PID cu fenotip fibrozant progresiv, deoarece declinul 6MWD poate oferi dovezi care susțin progresia fibrozei6
CONSIDERAȚII PENTRU MONITORIZAREA SPECIFICĂ A DIFERITELOR PID
PNEUMOPATIA INTERSTIȚIALĂ DIFUZĂ ASOCIATĂ SCLEROZEI SISTEMICE (PID-ScS)
Datorită naturii variabile și imprevizibile a fibrozei pulmonare în ScS, trebuie efectuată o monitorizare continuă vigilentă, cu HRCT repetată la înrăutățirea rezultatelor PFR sau a simptomatologiei respiratorii:11,18–21
- Toți pacienții cu PID-ScS trebuie urmăriți la fiecare 3-6 luni cu PFR și HRCT repetate conform deciziei clinice19,20
Algoritmul de monitorizare al PID-ScS19
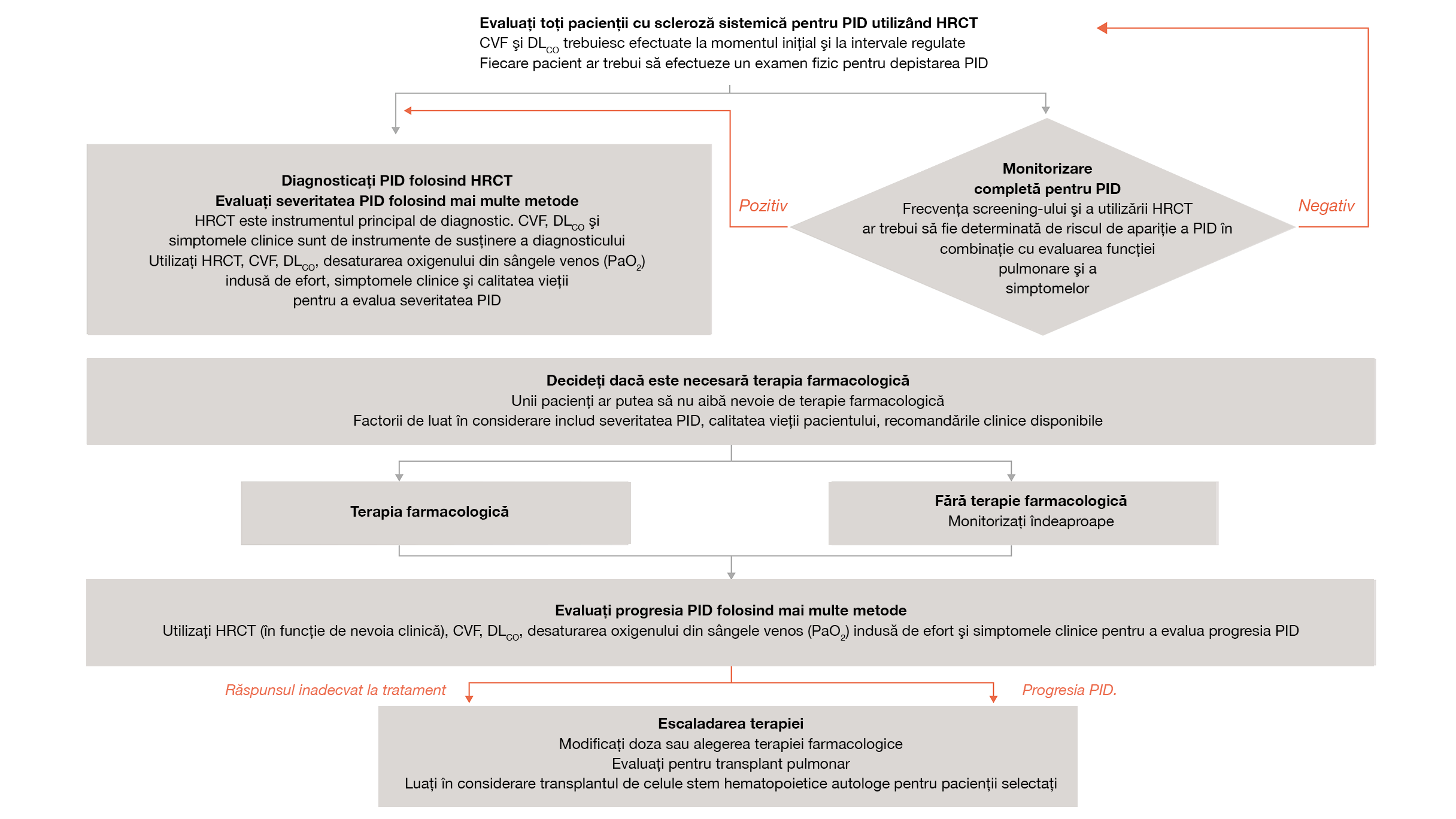
Algoritmul oferă un scurt rezumat al declarațiilor de consens bazate pe dovezi (inclusiv procesul Delphi suplimentar) pentru identificarea și gestionarea PID-ScS pentru utilizare în practica clinică. Datele de la pacienții cu PID-ScS trebuie extrapolate cu prudență la alte BTC
Adaptat după: Hoffmann-Vold A, et al. LancetRheumatol.2020;https://doi.org/10.1016/S2665-9913(19)30144-4.
Aflați mai multe despre monitorizarea progresiei PID în PID-ScS
PNEUMOPATIA INTERSTIȚIALĂ DIFUZĂ ASOCIATĂ ARTRITEI REUMATOIDE (PID-AR)
Monitorizarea este obligatorie la pacienții cu PID-AR asimptomatică pentru a identifica boala progresivă:22
-
Monitorizarea progresiei PID-AR folosind PFR este recomandată la fiecare 3-6 luni23
Ce altceva puteți face pentru a monitoriza progresia PID în PID-AR?
Ce opțiuni de management terapeutic ar trebui să luați în considerare pentru pacienții dumneavoastră cu PID cu fenotip fibrozant progresiv?

Intervențiile în cazul PID

Acordarea îngrijirilor paliative/suportive

Echipe multidisciplinare
Note
6MWD, test de șase minute de mers pe jos; BAL, lavaj bronhoalveolar; PHc, pneumonită cronică de hipersensibilitate; PID-BTC, pneumopatie interstițială difuză asociată bolii țesutului conjunctiv; DLCO, capacitatea de difuzie a plămânului pentru monoxid de carbon; CVF, capacitate vitală forțată; PH, pneumonită de hipersensibilitate; HRCT, tomografie computerizată de înaltă rezoluție; HRQoL, calitatea vieții legată de sănătate; PII, pneumonie interstițială idiopatică; PID, pneumopatie interstițială difuză; iNSIP, pneumonie interstițială nespecifică idiopatică; MDT, echipă multidisciplinară; NSIP, pneumonie interstițială nespecifică; PFR, probe funcționale respiratorii; PID-RA, pneumopatie interstițială difuză asociată artritei reumatoide; SSc, scleroză sistemică; PID-ScS, pneumopatie interstițială difuză asociată sclerozei sistemice.
- Raghu G, Collard HR, Egan JJ, et al; on behalf of the ATS/ERS/JRS/ALAT Committee on Idiopathic Pulmonary Fibrosis. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788-824.
- Wijsenbeek M, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019;35(11):2015–2024.
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
- Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
- George PM, Spagnolo P, Kreuter M, et al. Progressive fibrosing interstitial lung disease: clinical uncertainties, consensus recommendations, and research priorities. Lancet Respir Med. 2020;8:925–954.
- Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
- Cottin V, Richeldi L. Neglected evidence in idiopathic pulmonary fibrosis and the importance of early diagnosis and treatment. Eur Respir Rev. 2014;23(131):106–110.
- Lamas D, Kawut SM, Bagiella E, et al. Delayed Access and Survival in Idiopathic Pulmonary Fibrosis. Am J Respir Crit Care Med. 2011;184(7):842–847.
- Molina-Molina M, Aburto M, Acosta O, et al. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
- Chowaniec M, Skoczyńska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
- Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
- Chaudhuri N, Spencer L, Greaves M, et al. A Review of the Multidisciplinary Diagnosis of Interstitial Lung Diseases: A Retrospective Analysis in a Single UK Specialist Centre. J Clin Med. 2016;5(66):1–9.
- Martinez FJ, Flaherty K. Pulmonary function testing in idiopathic interstitial pneumonias. Proc Am Thorac Soc. 2006;3(4):315–321.
- Roofeh D, Jaafar S, Vummidi D, Khanna D. Management of systemic sclerosis-associated interstitial lung disease. Curr Opin Rheumatol. 2019;31(3):241–249.
- Walsh SLF, Devaraj A, Enghelmayer JI, et al. Role of imaging in progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180073.
- Elicker BM, Kallianos KG, Henry TS. The role of high-resolution computed tomography in the follow-up of diffuse lung disease: Number 2 in the Series “Radiology” Edited by Nicola Sverzellati and Sujal Desai. Eur Respir Rev. 2017;26(144):pii:170008.
- Hoffmann-Vold AM, Allanore Y, Alves M, et al. Progressive interstitial lung disease in patients with systemic sclerosis-associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020;217455.
- Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. The Lancet Rheumatology. 2020b;2: e71–e83.
- Distler O, Assassi S, Cottin V, et al. Predictors of progression in systemic sclerosis patients with interstitial lung disease. Eur Respir J. 2020;55, 1902026.
- Cappelli S, Bellando Randone S, Camiciottoli G, et al. Interstitial lung disease in systemic sclerosis: where do we stand? Eur Respir Rev. 2015;24:411–419.
- Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082.
- Iqbal K and Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
- Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
- Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
- Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
- Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
- Maher TM, Molina-Molina M, Russell AM, et al. Unmet needs in the treatment of idiopathic pulmonary fibrosis-insights from patient chart review in five European countries. BMC Pulm Med. 2017;17(1):124.
- Robalo-Cordeiro C, Campos P, Carvalho L, et al. Idiopathic pulmonary fibrosis in the era of antifibrotic therapy: Searching for new opportunities grounded in evidence. Rev Port Pneumol. 2017;23(5):287–293.
