Mortalitatea în PID
Fibroza pulmonară este un factor determinant al mortalității precoce la pacienții cu PID fibrozante.1–8

PID caracterizate de fibroză pulmonară sunt supuse riscului de mortalitate precoce.9–12
Rata mortalității la 5 ani a PID non-FPI7,13–19
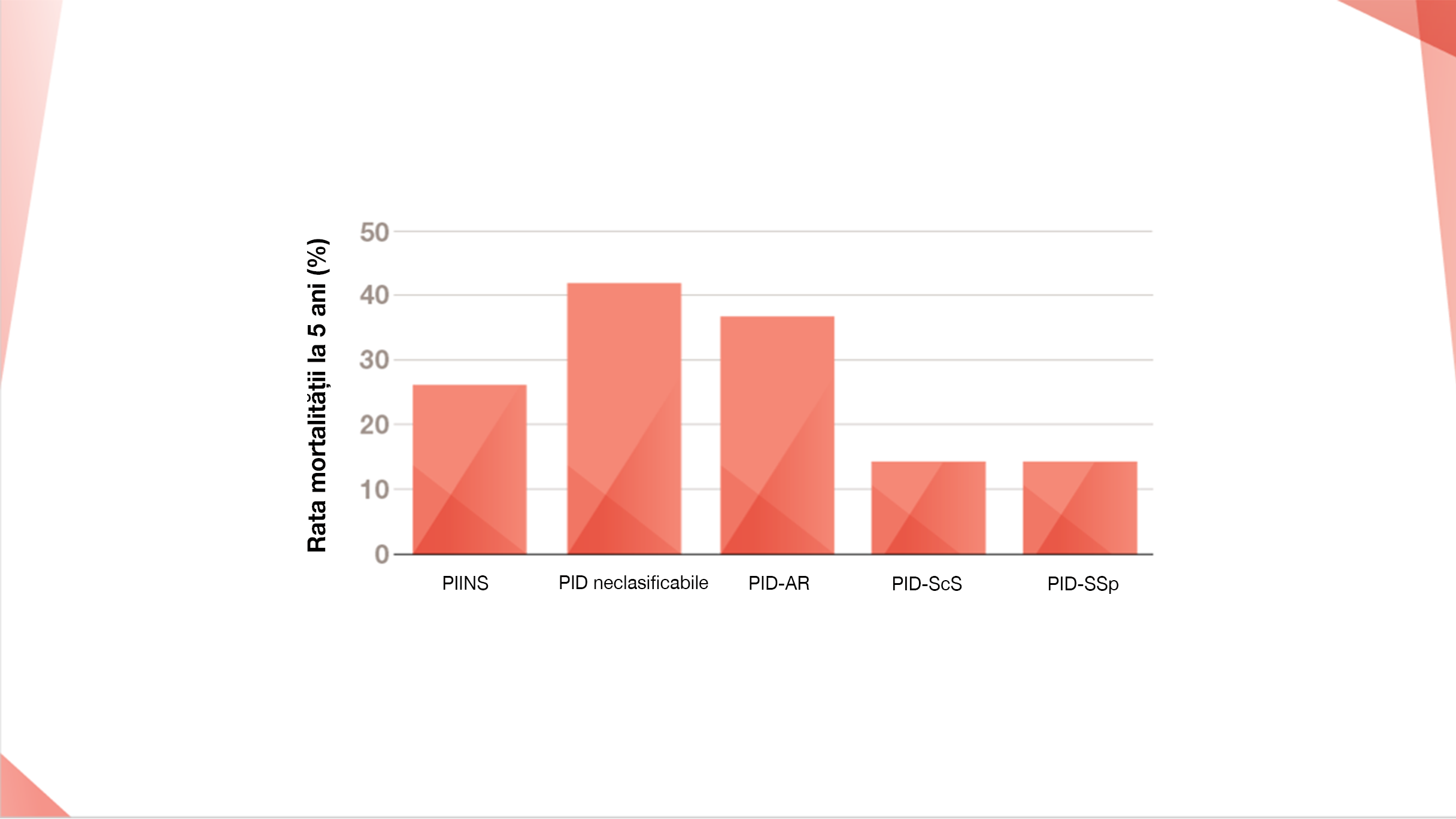
Rata mortalității la 5 ani rezultată dintr-un studiu retrospectiv.7
Ratele de mortalitate la 5 ani pentru PID neclasificabile, PID-AR, PID-ScS și PID-SpS provenite ca valori medii din intervalele pentru ratele de mortalitate pe 5 ani, după cum urmează:
PID neclasificabile, Rata mortalității la 5 ani 30%–54%.13 PID-AR Rata mortalității la 5 ani 35%–39%.14,15 PID-ScS Rata mortalității la 5 ani 10%–18%.16 PID-SSp Rata mortalității la 5 ani 12%–16%.17–19
PACIENȚII CU PID NON-FPI POT DEZVOLTA UN FENOTIP FIBROZANT PROGRESIV, CARE PRESUPUNE UN RISC DE MORTALITATE PRECOCE, LA FEL ÎN CAZUL FPI20
Fenotipul fibrozant progresiv se caracterizează prin extinderea progresivă a fibrozei, agravarea simptomelor respiratorii și declinul funcției pulmonare9,21–23
Pacienții diagnosticați cu FPI sau cu PID non-FPI și cu fibroză pulmonară progresivă se confruntă cu un prognostic sumbru20,24
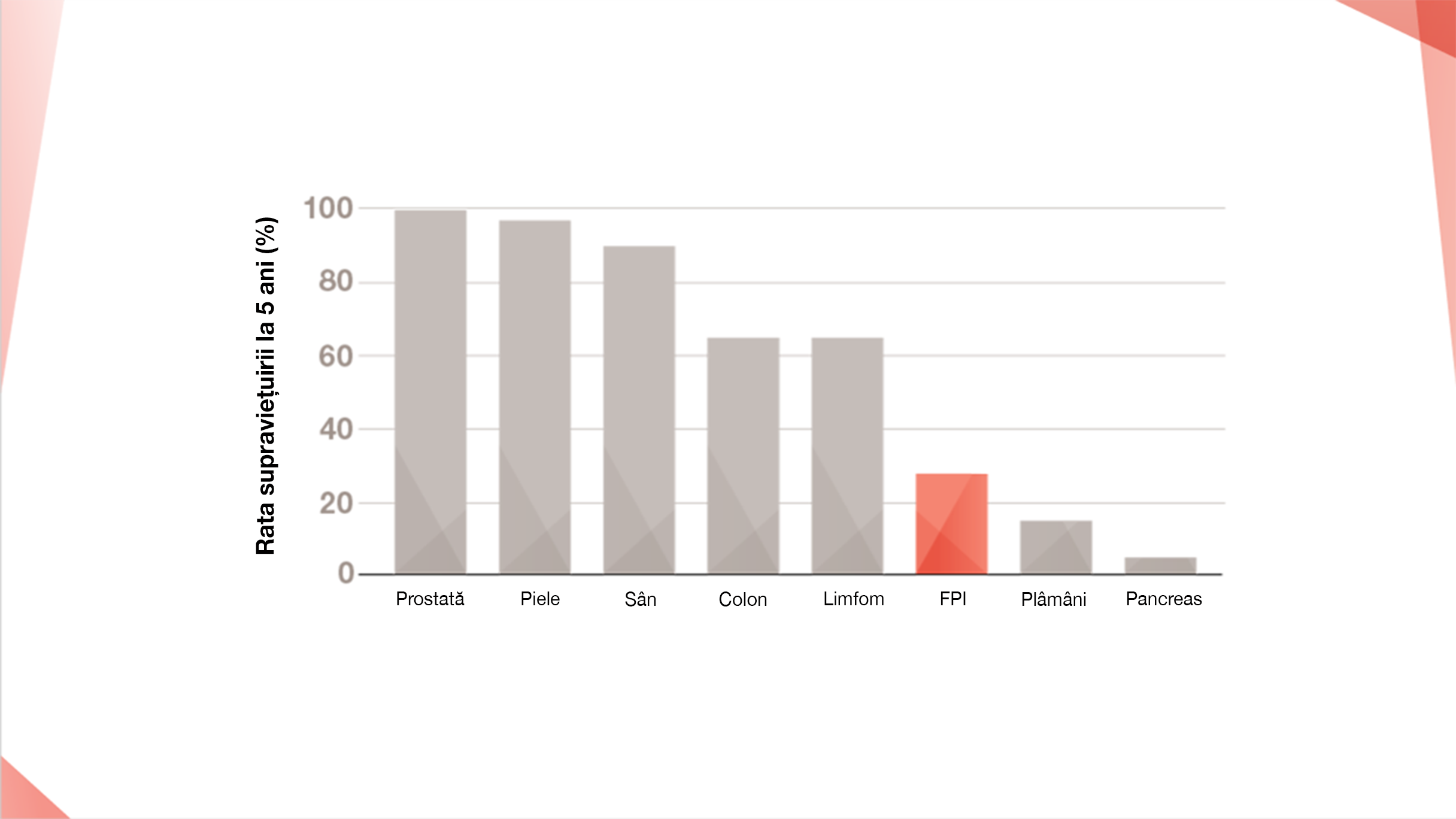
CUM SE COMPARĂ PROGNOSTICUL FPI CU ALTE AFECȚIUNI?
FPI are o supraviețuire la 5 ani mai scăzută decât în cazul multor tipuri de cancer, inclusiv de sân, prostată, colon, melanom și limfom8
Pacienții cu PID, cum ar fi PID-AR, au un risc crescut de mortalitate,9–11 dar pericolul cel mai mare este cazul pacienților cu FPI26
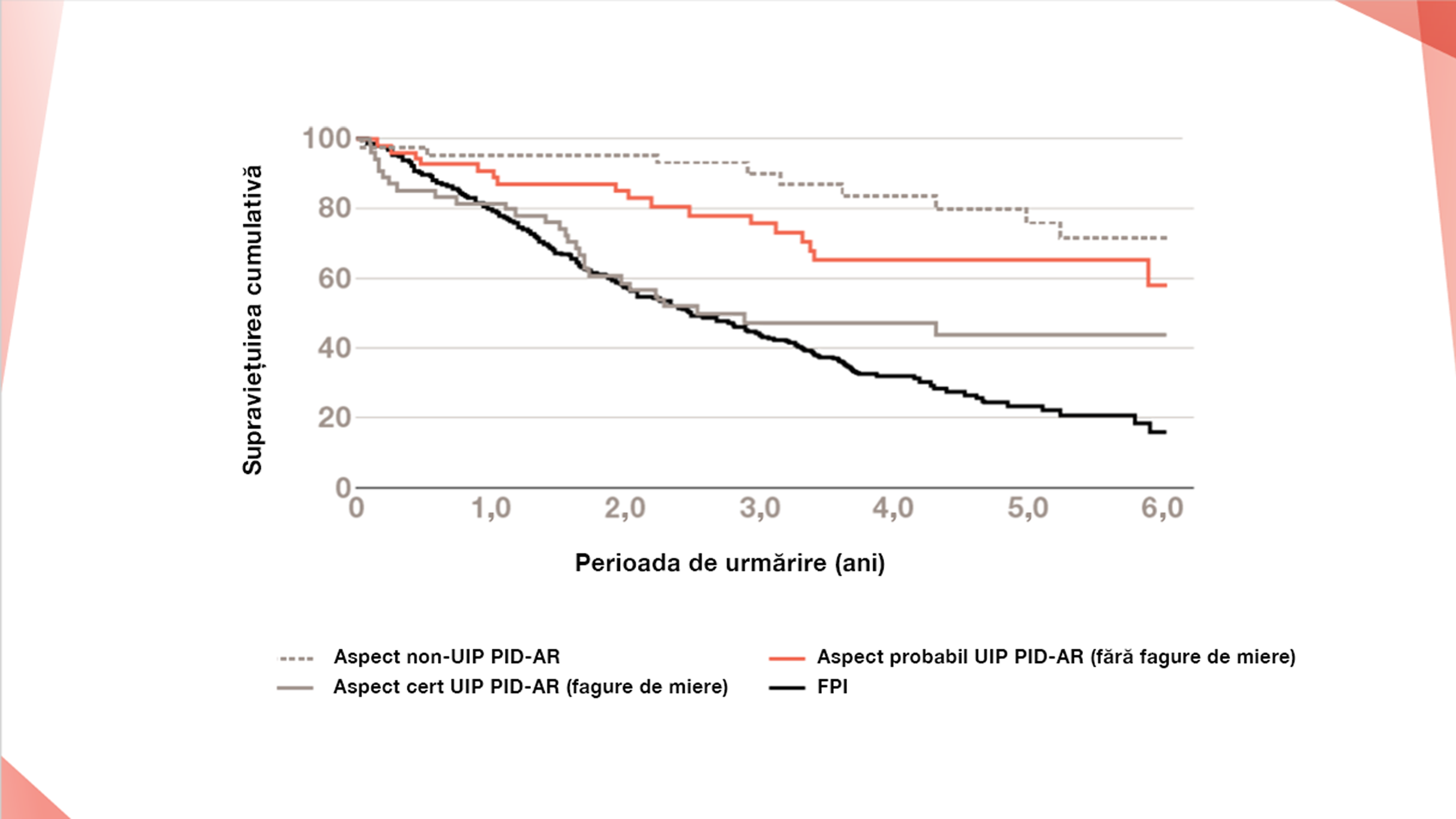
Curba Kaplan-Meier care demonstrează mortalitatea la pacienții cu FPI față de pacienții cu PID-AR subdivizată conform ghidurilor de diagnosticare ale FPI emise de Societatea Fleischner privind modelul HRCT.
Adaptat după: Jacob J et al. Eur Respir J. 2019;53:pii1800869
Modelul cert UIP în PID-AR (fagure de miere): 48% supraviețuire la 3 ani și 45% la 6 ani, n=55. Supraviețuirea medie 3,5 ani
Model probabil UIP în PID-AR (fără fagure de miere): 76% supraviețuire la 3 ani și 58% la 6 ani, n=56. Supraviețuirea medie 4,6 ani
Aspect PID-AR non-UIP: 92% supraviețuire la 3 ani și 75% la 6 ani, n=46. Supraviețuirea medie 5,3 ani
FPI: 42% supraviețuire la 3 ani și 18% la 6 ani, n=284. Supraviețuirea medie 2,9 ani
Comparativ cu NSIP fibrozant, pacienții cu FPI au o rată de supraviețuire mai scăzută27
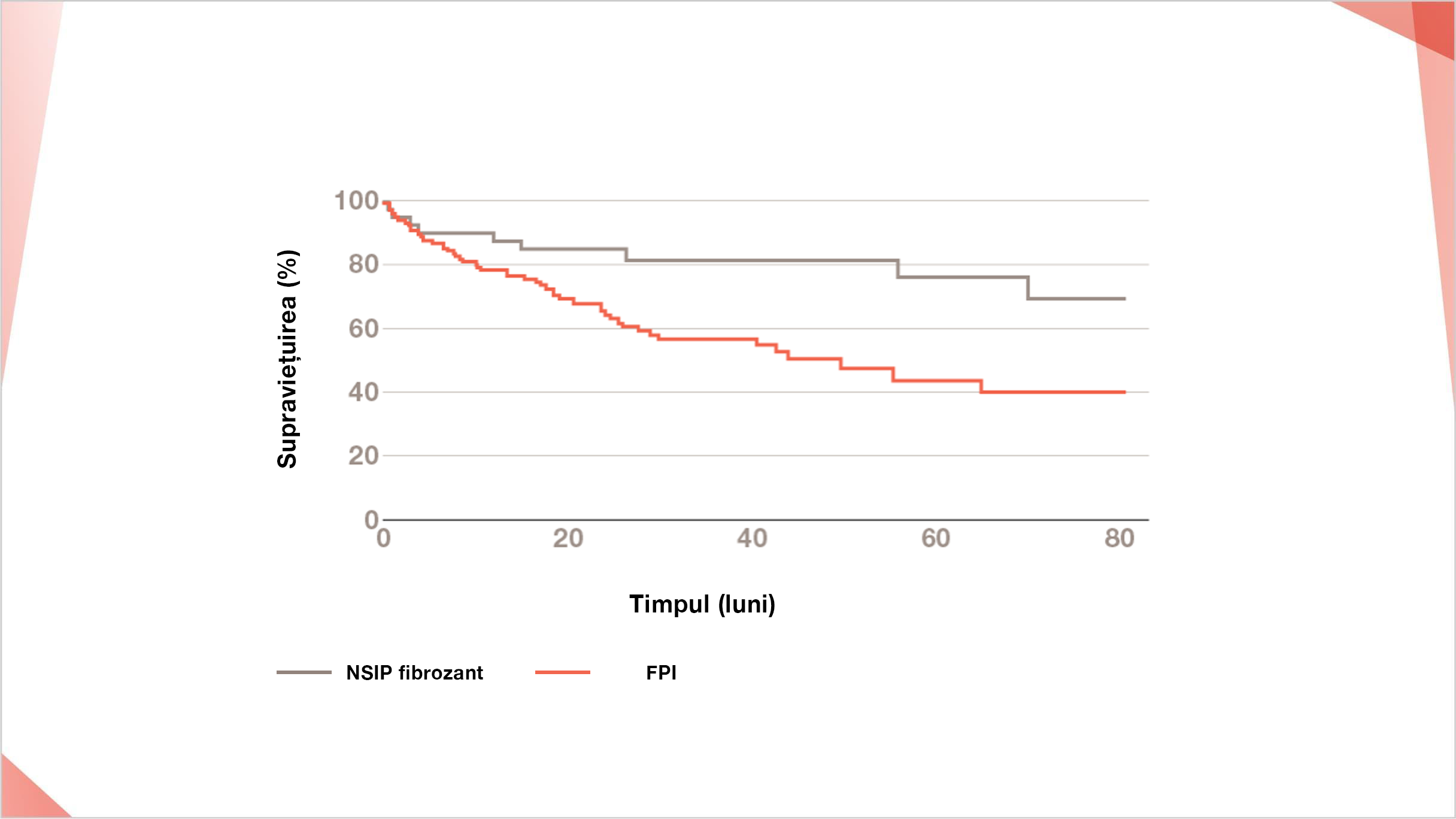
Rata de supraviețuire la 5 ani a pacienților cu NSIP fibrozant (n=41) a fost de 76,2% față de 43,8% în cazul pacienților cu FPI (n=131) (p=0,007).
Modificările la 6 luni ale CVF și DLco inițial precum și sexul masculin sunt factori predictivi statistic semnificativi pentru supraviețuirea la pacienții cu NSIP fibrozant și FPI27
| Hazard Ratio | 95% IC | Valoarea P |
|---|---|---|---|
Vârstă | 1,027 | 0,992–1,064 | 0,134 |
Gen* | 2,724 | 1,277–5,813 | 0,010 |
Diagnostic NSIP | 0,854 | 0,349–2,093 | 0,730 |
IFVC inițial, % din valoarea prezisă* | 0,987 | 0,964–1,010 | 0,262 |
DLco inițial, % din valoarea prezisă* | 0,972 | 0,949–0,996 | 0,022 |
Modificarea la 6 luni a CVF* | 0,925 | 0,893–0,958 | <0,001 |
PaO2 de repaus | 0,995 | 0,961–1,031 | 0,798 |
Rezultatele analizei multivariate a factorilor de prognostic ai pacienților cu NSIP fibrozant (n=41) și FPI (n=131) după 6 luni de urmărire.
*Analiza ca și variabile de continuitate
PACIENȚII CU PID CU FENOTIP FIBROZANT SE AFLĂ LA RISC DE MORTALITATE PRECOCE20

Pacienții cu PID cu fenotip fibrozant progresiv non-FPI au o durată de supraviețuire estimată de 2,5–4 ani20*†

PID este principala cauză de deces în ScS, reprezentând aproximativ 35% din decesele legate de ScS32–37
Înțelegerea și identificarea riscului de mortalitate la pacienții dumneavoastră

PID non-FPI pot dezvolta, de asemenea, un fenotip progresiv
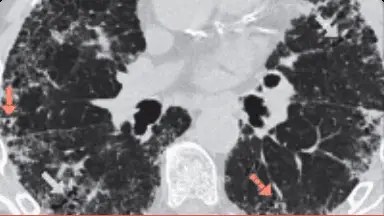
Investigarea PID cu fenotip fibrozant progresiv cu ajutorul imagisticii HRCT
Exacerbarea acută în PID
Note
-
*
Timpul estimat între detectarea fibrozei progresive și deces.
-
†
Estimări privind pacienții cu PID non-FPI care dezvoltă fibroză progresivă bazate pe un sondaj online cu un total de 486 de medici (243 de pneumologi, 203 de reumatologi și 40 de interniști) din Statele Unite, Japonia, Franța, Germania, Italia, Spania și Regatul Unit).20
- Fischer A and Distler J. Progressive fibrosing interstitial lung disease associated with systemic autoimmune diseases. Clin Rheumatol. 2019;38(10):2673–2681.
- Mathai SC and Danoff SK. Management of interstitial lung disease associated with connective tissue disease. BMJ. 2016;352:h6819.
- Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
- Spagnolo P, Cordier JF, Cottin V. Connective tissue diseases, multimorbidity and the ageing lung. Eur Respir J. 2016;47(5):1535–1558.
- Vacchi C, Sebastiani M, Cassone G, et al. Therapeutic options for the treatment of interstitial lung disease related to connective tissue diseases. A narrative review. J Clin Med. 2020;9(2):407. doi: 10.3390/jcm9020407.
- Maher TM, Wuyts W. Management of fibrosing interstitial lung diseases. Adv Ther. 2019;36(7):1518–1531.
- Park IN, Jegal Y, Kim DS, et al. Clinical course and lung function change of idiopathic nonspecific interstitial pneumonia. Eur Respir J. 2009;33(1):68–76.
- Vancheri C, Failla M, Crimi N, Raghu G. Idiopathic pulmonary fibrosis: a disease with similarities and links to cancer biology. Eur Respir J. 2010;35(3):496–504.
- Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: a double-blind, randomised, placebo-controlled phase III trial of ... in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
- Patterson KC, Strek ME. Pulmonary fibrosis in sarcoidosis. Clinical features and outcomes. Ann Am Thorac Soc. 2013;10(4):362-370.
- Caban JJ, Yao J, Bagci U, Mollura DJ. Monitoring pulmonary fibrosis by fusing clinical, physiological, and computed tomography features. Conf Proc IEEE Eng Med Biol Soc. 2011;6216-6219.
- Wells AU, Brown KK, Flaherty KR, Kolb M, Thannickal VJ, on behalf of the IPF Consensus Working Group. Eur Resp J. 2018;51:1800692.
- Guler SA, Ellison K, Algamdi M, et al. Heterogeneity in Unclassifiable Interstitial Lung Disease: A Systematic Review and Meta-Analysis. Ann Am Thorac Soc. 2018;15:854–863.
- Hyldgaard C, Hilberg O, Pedersen AB, et al. A population-based cohort study of rheumatoid arthritis-associated interstitial lung disease: comorbidity and mortality. Ann Rheum Dis. 2017;76(10):1700–1706.
- Raimundo K, Solomon JJ, Olson AL, et al. Rheumatoid arthritis – interstitial lung disease in the United States: prevalence, incidence, and healthcare costs and mortality. J Rheumatol. 2019;46(4):360–369.
- Bouros D, Wells AU, Nicholson AG, et al. Histopathologic Subsets of Fibrosing Alveolitis in Patients with Systemic Sclerosis and Their Relationship to Outcome. Am J Respir Crit Care Med. 2002;165:1581–1586.
- Palm Ø, Garen T, Enger TV, et al. Clinical pulmonary involvement in primary Sjögren’s syndrome: prevalence, quality of life and mortality—a retrospective study based on registry data. Rheumatology. 2013;52:173-179.
- Ito I, Nagai S, Kitaichi M, et al. Pulmonary Manifestations of Primary Sjögren’s Syndrome: A Clinical, Radiologic, and Pathologic Study. Am J Respir Crit Care Med. 2005;171:632–638.
- Enomoto Y, Takemura T, Hagiwara E, et al. Prognostic Factors in Interstitial Lung Disease Associated with Primary Sjögren’s Syndrome: A Retrospective Analysis of 33 Pathologically–Proven Cases. PLoS One. 2013;8:e73774.
- Wijsenbeek M, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019;35(11):2015–2024.
- Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
- Molina-Molina M, Aburto M, Acosta O, et al. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
- Nathan SD, du Bois RM. Idiopathic pulmonary fibrosis trials: recommendations for the jury. Eur Respir J. 2011;38(5):1002-1004.
- Jacob J, Hirani N, van Moorsel CHM, et al. Predicting outcomes in rheumatoid arthritis related interstitial lung disease. Eur Respir J. 2019;53:1800869.
- Jegal Y, Kim DS, Shim TS, et al. Physiology Is a Stronger Predictor of Survival than Pathology in Fibrotic Interstitial Pneumonia. Am J Respir Crit Care Med. 2005;171:639–644.
- Bongartz T, Nannini C, Medina-Velasquez YF, et al. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum. 2010;62(6):1583–1591.
- Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082.
- Olson AL, Swigris JJ, Sprunger DB, et al. Rheumatoid Arthritis–Interstitial Lung Disease–associated Mortality. Am J Respir Crit Care Med. 2011;183:372–378.
- Hyldgaard C, Ellingsen T, Hilberg O, et al. Rheumatoid arthritis-associated interstitial lung disease: clinical characteristics and predictors of mortality. Respiration. 2019;98(5):455–460.
- Cappelli S, Bellando Randone S, Camiciottoli G, et al. Interstitial lung disease in systemic sclerosis: where do we stand? Eur Respir Rev. 2015;24;411–419.
- Distler O, Assassi S, Cottin V, et al. Predictors of progression in systemic sclerosis patients with interstitial lung disease. Eur Respir J. 2020;55;1902026.
- Distler O, Volkmann ER, Hoffmann-Vold AM, et al. Current and future perspectives on management of systemic sclerosis-associated interstitial lung disease. Expert Rev Clin Immunol. 2019;15;1009–1017.
- Tyndall AJ, et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis. 2010;69(10):1809-1815. doi:10.1136/ ard.2009.114264.
- Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972-2002. Ann Rheum Dis. 2007;66(7):940-944. doi:10.1136/ard.2006.066068.
- Roofeh D, Jaafar S, Vummidi D, et al. Management of systemic sclerosis-associated interstitial lung disease. Curr Opin Rheumatol. 2019;31;241–249.
- Brauner M, et al. Imagerie des pneumopathies infiltrantes diffuses. Press Med. 2010;39:73–84.
- Kolb M, Bondue B, Pesci A, et al. Acute exacerbations of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180071.
- Song JW, Hong S-B, Lim C-M, et al. Acute exacerbation of idiopathic pulmonary fibrosis: incidence, risk factors and outcome. Eur Respir J. 2011;37(2):356–363.
- Song JW, Lee HK, Lee CK, et al. Clinical course and outcome of rheumatoid arthritis-related usual interstitial pneumonia. Sarcoidosis Vasc Diffuse Lung Dis. 2013;30(2):103-112.
- Tomiyama F, Watanabe R, Ishii T, et al. High Prevalence of Acute Exacerbation of Interstitial Lung Disease in Japanese Patients with Systemic Sclerosis. Tohoku J. Exp. Med. 2016;239, 297–305.
- Okamoto M, Fujimoto K, Sadohara J, et al. A retrospective cohort study of outcome in systemic sclerosis-associated interstitial lung disease. Respiratory Investigation. 2016;54, 445–453.

