Fiziopatologia PID fibrozante
În timp ce PID sunt diferite, căile patogenice către fibrogeneză sunt comune1–5

Căile patogenice ale fibrogenezei1–5
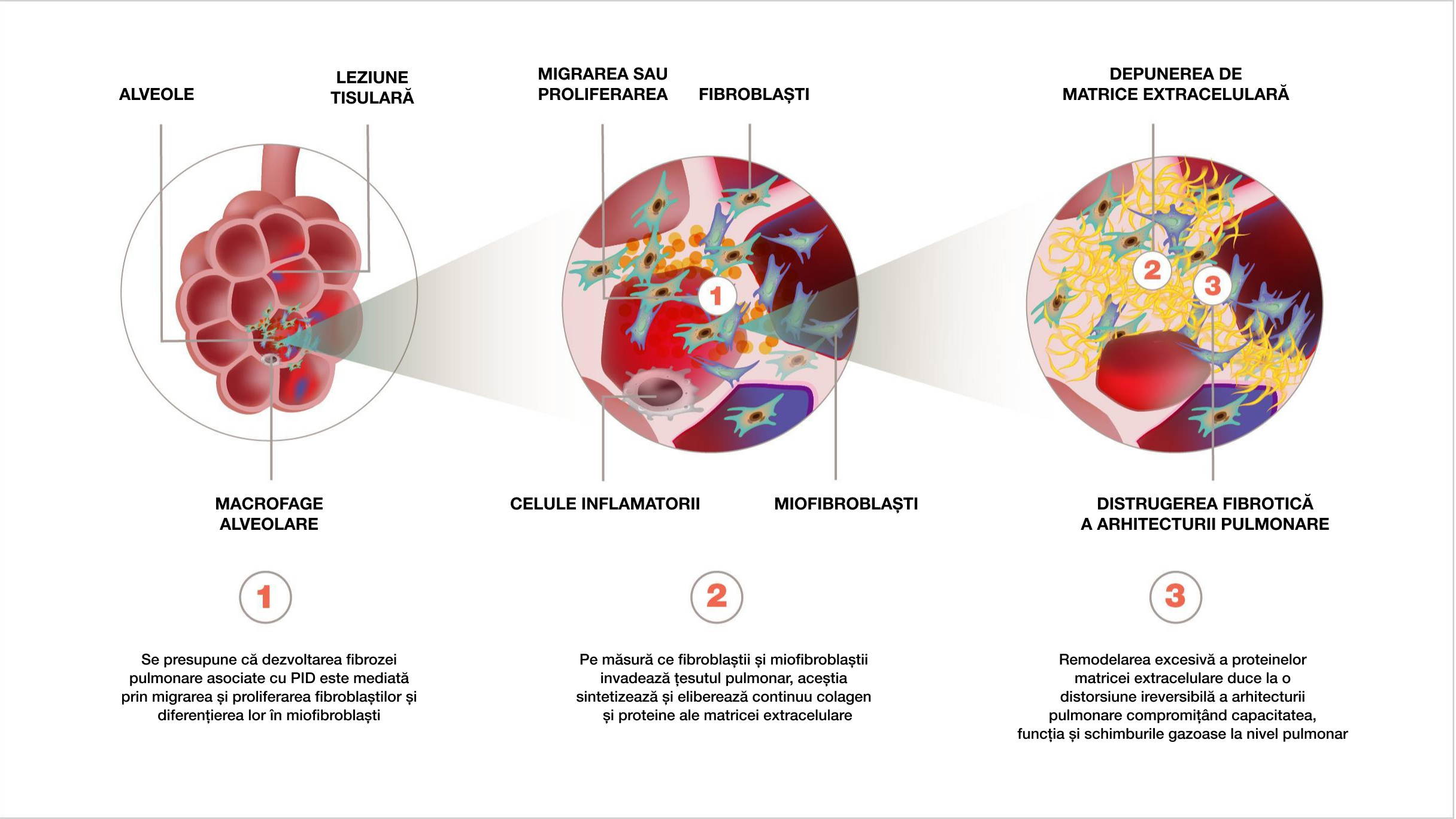
Indiferent de declanșarea leziunii pulmonare, PID cu fenotip fibrozant progresiv prezintă puncte comune nu numai în comportamentul bolii, ci și în mecanismele patogenice care conduc la apariția procesului fibrotic.3,6
Aceste mecanisme culminează cu pierderea ireversibilă a integrității barierei epiteliale sau endoteliale, distrugerea arhitecturii pulmonare și pierderea funcției pulmonare.3,6
EFECTELE DISTRUCTIVE AUTOÎNTREȚINUTE ALE FIBROZEI PROGRESIVE ÎN PID
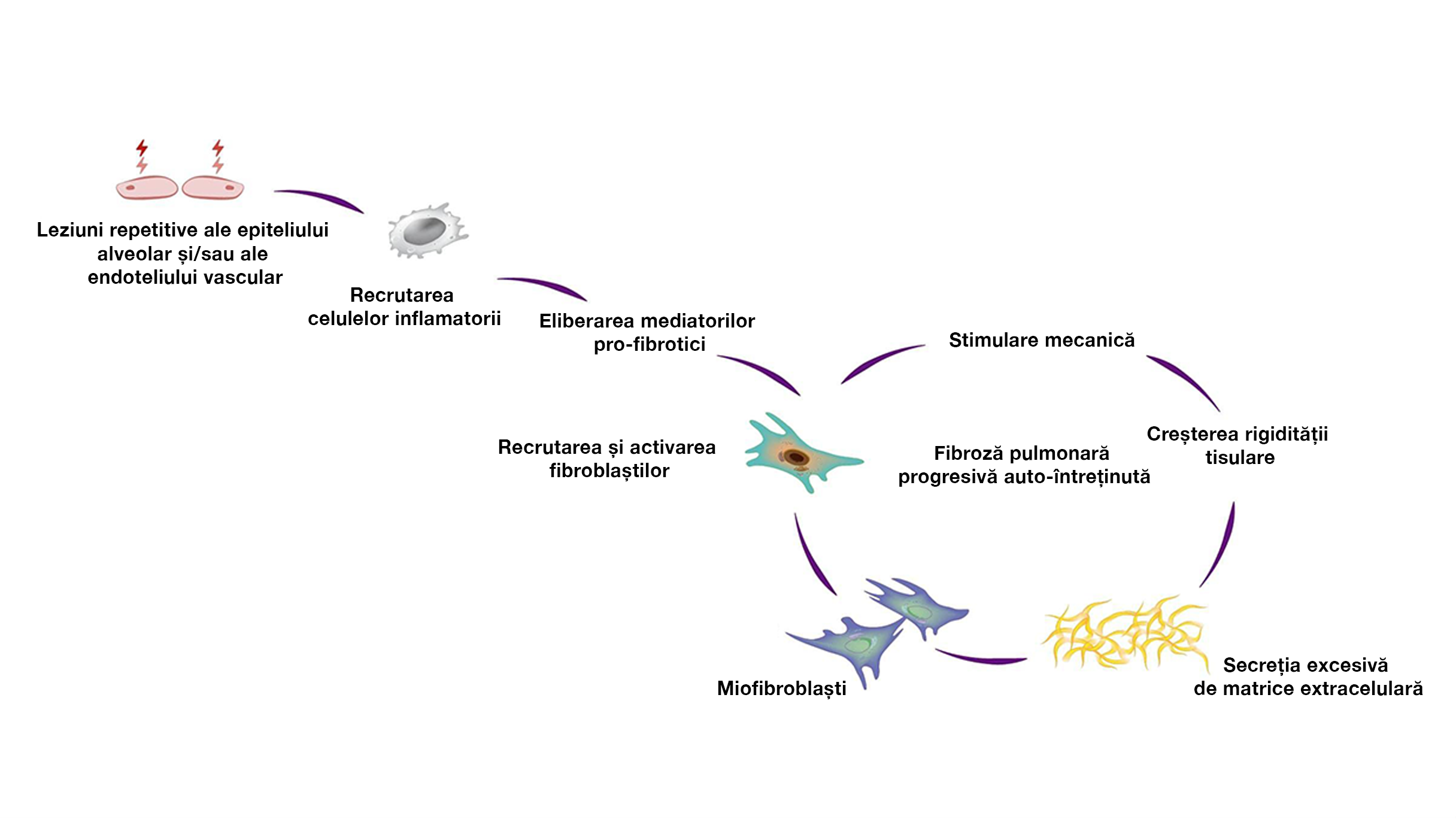
Secreția excesivă de matrice extracelulară poate duce la un proces auto-întreținut de fibroză progresivă, în care rigiditatea ulterioară a țesuturilor și eliberarea de citokine profibrotice activează în continuare fibroblaștii.7
Mecanismele care contribuie la auto-întreținerea fibrozei progresive în PID cu fenotip fibrozant progresiv, indiferent de afecțiunea inițială sau de factorii declanșatori8
PROGRESIA POATE FI AUTO-ÎNTREȚINUTĂ CHIAR DUPĂ ÎNLĂTURAREA FACTORILOR DECLANȘATORI9,10
Pacienții cu PH cronică pot dezvolta o pneumopatie fibrozantă progresivă în pofida absenței expunerii continue la antigenul declanșator.9
În cazul PID determinate de expunere (de exemplu, silicoză), progresia simptomelor și severitatea bolii pot apărea chiar și după încetarea expunerii la agenții exogeni.10
MECANISME COMUNE ALE FIBROZEI PULMONARE PROGRESIVE
Aflați despre mecanismele fiziopatologice comune din spatele fibrogenezei și despre cum se explică comportamentul auto-întreținut al bolii în cazul PID cu fenotip fibrozant progresiv
Cum puteți identifica fenotipul progresiv la pacienții cu PID cu fenotip fibrozant progresiv?
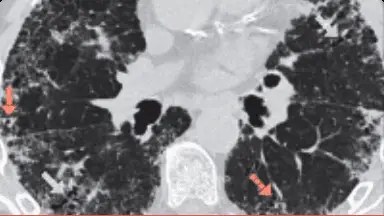
Investigarea imagistică a PID cu fenotip fibrozant progresiv cu ajutorul HRCT
Monitorizare precoce și regulată
Diagnosticul de PID
PH, pneumonită de hipersensibilitate; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză.
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Selman M, King TE, Pardo A, et al. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134(2):136–151.
- Wuyts WA, Agostini C, Antoniou KM, et al. The pathogenesis of pulmonary fibrosis: a moving target. Eur Respir J. 2013;41(5):1207–1218.
- Bagnato G, Harari S. Cellular interactions in the pathogenesis of interstitial lung diseases. Eur Respir Rev. 2015;24(135):102–114.
- Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
- Maher TM, Wuyts W. Management of fibrosing interstitial lung diseases. Adv Ther. 2019;36(7):1518–1531.
- Fischer A and Distler J. Progressive fibrosing interstitial lung disease associated with systemic autoimmune diseases. Clin Rheumatol. 2019;38(10):2673–2681.
- Wollin L, Distler JHW, Redente EF, et al. Potential of nintedanib in treatment of progressive fibrosing interstitial lung diseases. Eur Respir J. 2019;54(3):1900161. doi: 10.1183/13993003.00161-2019.
- Fernández Pérez ER, Swigris JJ, Forssén AV, et al. Identifying an inciting antigen is associated with improved survival in patients with chronic hypersensitivity pneumonitis. Chest. 2013;144(5):1644–1651.
- Khalil N, Churg A, Muller N, O’Connor R. Environmental, inhaled and ingested causes of pulmonary fibrosis. Toxicol Pathol. 2007;35(1):86-96.
- Brauner M, et al. Imagerie des pneumopathies infiltrantes diffuses. Press Med. 2010;39:73–84.
- Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
- Theodore AC, Tseng C-H, Li N, Elashoff RM, Tashkin DP. Correlation of cough with disease activity and treatment with cyclophosphamide in scleroderma interstitial lung disease: findings from the Scleroderma Lung Study. Chest. 2012;142(3):614–621.
- Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200:1258–1266.
- Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. The Lancet Rheumatology. 2020b;2: e71–e83.
- Asano Y, Jinnin M, Kawaguchi Y, et al. Diagnostic criteria, severity classification and guidelines of systemic sclerosis: Guideline of SSc. J Dermatol. 2018;45, 633–691.
