Evaluarea inițială a PID
Identificarea fibrozei pulmonare cât mai devreme posibil poate ajuta la îmbunătățirea stării de sănătate a pacienților, la încetinirea declinului activităților zilnice și a calității vieții și la reducerea riscului de mortalitate precoce1–4

Pentru pacienții cu risc, HRCT trebuie evaluată la prima suspiciune de apariție a PID, acolo unde este cazul la momentul diagnosticului inițial în cazul unei boli de țesut conjunctiv (BTC) subiacente și trebuie repetată la agravarea fie a PFR, fie a simptomatologiei respiratorii.5–9
SEMNE ȘI SIMPTOME CARE RIDICĂ SUSPICIUNEA DE FPI
Un pacient, de obicei în vârstă de peste 60 de ani, cu dispnee la efort, tuse neproductivă, degete hipocratice sau, cel mai evident, raluri crepitante la auscultație, ar trebui să ridice suspiciuni.10–12

Dispnee
Tuse

Degete hipocratice

Raluri crepitante
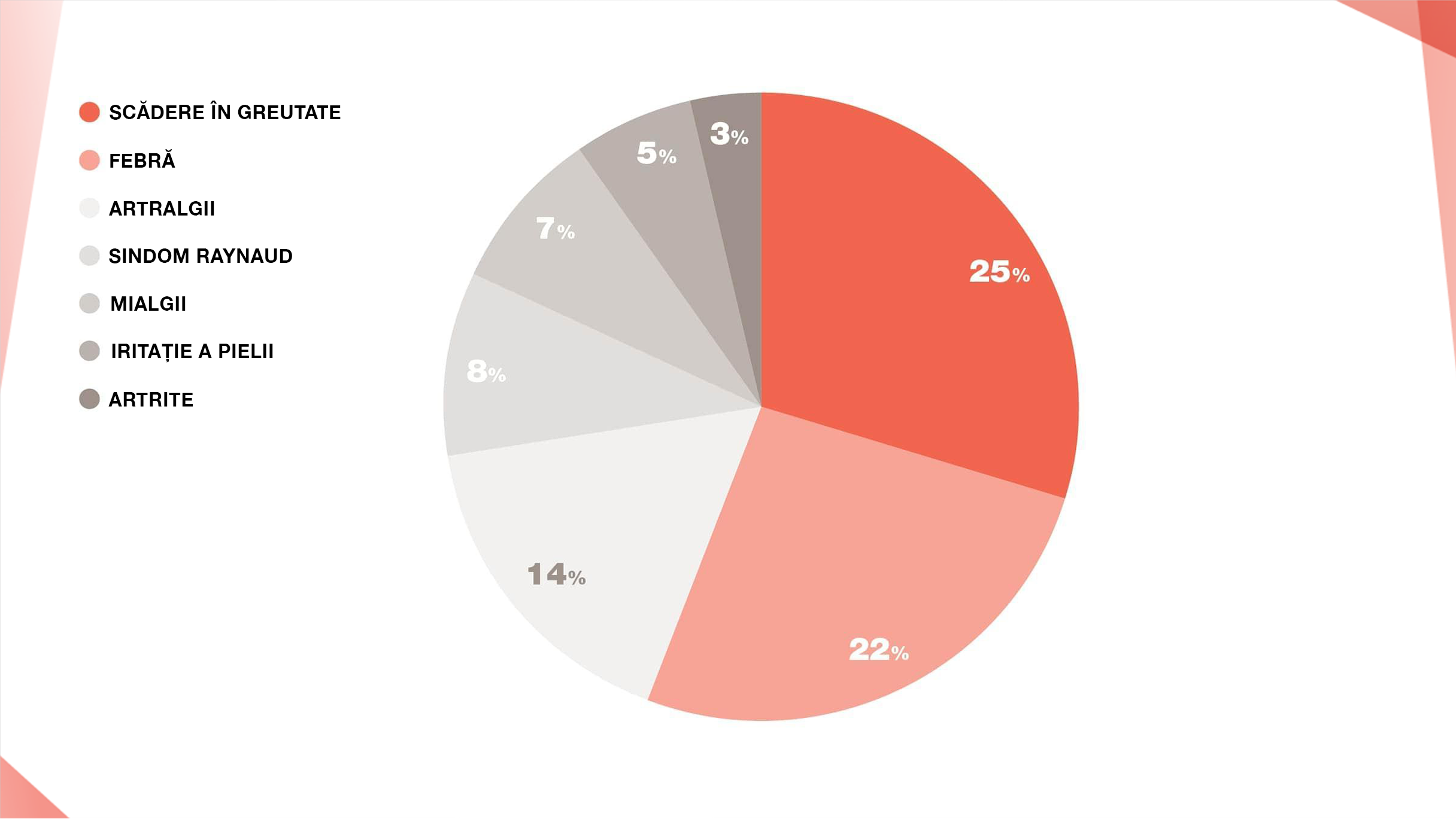
SEMNE ȘI SIMPTOME ALE PID NON-FPI
PREZENTAREA CLINICĂ A PNEUMONITEI DE HIPERSENSIBILITATE (PH)
PH subacută se poate prezenta cu febră, iar PH subacută sau PHc poate prezenta dispnee de efort, tuse, oboseală, stare generală de rău, anorexie și/sau scădere ponderală.15
Examenul fizic evidențiază de obicei tahipnee și raluri crepitante inspiratorii bibazilare.15 La unii pacienți poate apărea wheezing.
PREZENTAREA CLINICĂ A PNEUMOPATIEI INTERSTIȚIALE ASOCIATĂ CU SARCOIDOZĂ
Pneumopatia interstițială difuză asociată cu sarcoidoză se poate prezenta cu dispnee, tuse, dureri la nivelul toracelui anterior și raluri pulmonare iar afectarea pulmonară poate fi de obicei identificată prin radiografie toracică anormală:16
SCREENING PENTRU PNEUMOPATIA INTERSTIȚIALĂ DIFUZĂ ASOCIATĂ SCLEROZEI SISTEMICE (PID-ScS)
Se recomandă ca toți pacienții să fie examinați pentru PID la diagnosticul inițial de ScS.7–9 Screening-ul pentru PID la pacienții cu ScS ar trebui să implice o evaluare clinică amănunțită, inclusiv imagistica toracică cu HRCT, PFR, DLCO și auscultație.3,8,19,20
Aflați mai multe despre screening-ul pentru PID la pacienții cu ScS
SCREENING PENTRU PNEUMOPATIA INTERSTIȚIALĂ DIFUZĂ ASOCIATĂ CU ARTRITA REUMATOIDĂ (PID-AR)
Se recomandă ca pacienții cu factori de risc pentru PID sau simptomatologie respiratorie să fie evaluați folosind PFR și HRCT la diagnosticul inițial de AR.21–24
Cum puteți depista PID la pacienții cu AR?
Cum puteți confirma un diagnostic de PID la pacienții dumneavoastră după screening?
Diagnosticul PID

Cazuri de pacienți cu PID pentru evaluare și diagnostic

Echipe multidisciplinare
PHc, pneumonită cronică de hipersensibilitate; BTC, boala țesutului conjunctiv; DLCO, capacitatea de difuzie a plămânului pentru monoxid de carbon; PH, pneumonită de hipersensibilitate; HRCT, tomografie computerizată de înaltă rezoluție; BPI, boală pulmonară interstițială; PIINS, pneumopatie interstițială nespecifică idiopatică; FPI, fibroză pulmonară idiopatică; PFR, probe funcționale respiratorii; AR artrită reumatoidă;PID-AR, pneumopatie interstițială difuză asociată artritei reumatoide; ScS, scleroză sistemică; PID-SCS, pneumopatie interstițială difuză asociată sclerozei sistemice.
- Chaudhuri N, Spencer L, Greaves M, et al. A Review of the Multidisciplinary Diagnosis of Interstitial Lung Diseases: A Retrospective Analysis in a Single UK Specialist Centre. J Clin Med. 2016;5(66):1–9.
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
- Wong AW, Ryerson C, Guler S. Progression of fibrosing interstitial lung disease. Respir Res. 2020:29;21(1):32.
- Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
- Theodore AC, Tseng C-H, Li N, Elashoff RM, Tashkin DP. Correlation of cough with disease activity and treatment with cyclophosphamide in scleroderma interstitial lung disease: findings from the Scleroderma Lung Study. Chest. 2012;142(3):614–621.
- Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200:1258–1266.
- Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. The Lancet Rheumatology. 2020b;2: e71–e83.
- Asano Y, Jinnin M, Kawaguchi Y, et al. Diagnostic criteria, severity classification and guidelines of systemic sclerosis: Guideline of SSc. J Dermatol. 2018;45, 633–691.
- Raghu G, Collard HR, Egan JJ, et al; on behalf of the ATS/ERS/JRS/ALAT Committee on Idiopathic Pulmonary Fibrosis. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788–824.
- Molina-Molina M, Aburto M, Acosta O, et al. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
- Oldham JM, Noth I. Idiopathic pulmonary fibrosis: early detection and referral. Respir Med. 2014;108(6):819–829.
- Travis WD, Hunninghake G, King Jr TE, et al. Idiopathic nonspecific interstitial pneumonia: report of an American Thoracic Society project. Am J Respir Care Med. 2008;177:1338–1347.
- Tomassetti S, Ryu JH, Piciucchi, et al. Nonspecific Interstitial Pneumonia: What Is the Optimal Approach to Management? Semin Respir Crit Care Med. 2016;37:378–394.
- Selman M, Buendia-Roldan I. Immunopathology, diagnosis, and management of hypersensitivity pneumonitis. Semin Respir Crit Care Med. 2012;33:543–554.
- American Thoracic Society. Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG) adopted by the ATS Board of Directors and by the ERS Executive Committee, February 1999. Am J Respir Med. 1999;160:736–755.
- Ianuzzi MC, Sah BP. Sarcoidosis. Merck Manual Professional Version website. Available at: https://www.merckmanuals.com/professional/pulmonary-disorders/sarcoidosis/sarcoidosis. August 2017. Accessed: November 2020.
- Patterson KC, Strek ME. Pulmonary fibrosis in sarcoidosis. Clinical features and outcomes. Ann Am Thorac Soc. 2013;10:362–370.
- Roofeh D, Jaafar S, Vummidi D, Khanna D. Management of systemic sclerosis-associated interstitial lung disease. Curr Opin Rheumatol. 2019;31(3):241–249.
- Hoffmann-Vold A, Aaløkken TM, Lund MB, et al. Predictive Value of Serial High-Resolution Computed Tomography Analyses and Concurrent Lung Function Tests in Systemic Sclerosis. Arthritis Rheumatol. 2015;67:2205–2212.
- Esposito AJ, Chu SG, Madan R, et al. Thoracic manifestations of rheumatoid arthritis. Clin Chest Med. 2019;40(3):545–560.
- Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
- Cottin V and Cordier JF. Subclinical interstitial lung disease: no place for crackles? Am J Respir Crit Care Med. 2012;186(3):289–290.
- Lake F and Proudman S. Rheumatoid arthritis and lung disease: from mechanisms to a practical approach. Semin Respir Crit Care Med. 2014;35(2):222–238.
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.