PID cu fenotip fibrozant progresiv
18% până la 32% dintre pacienții cu PID non-FPI pot dezvolta un fenotip fibrozant progresiv1

IDENTIFICAREA FENOTIPULUI FIBROZANT PROGRESIV ÎN CAZUL PID
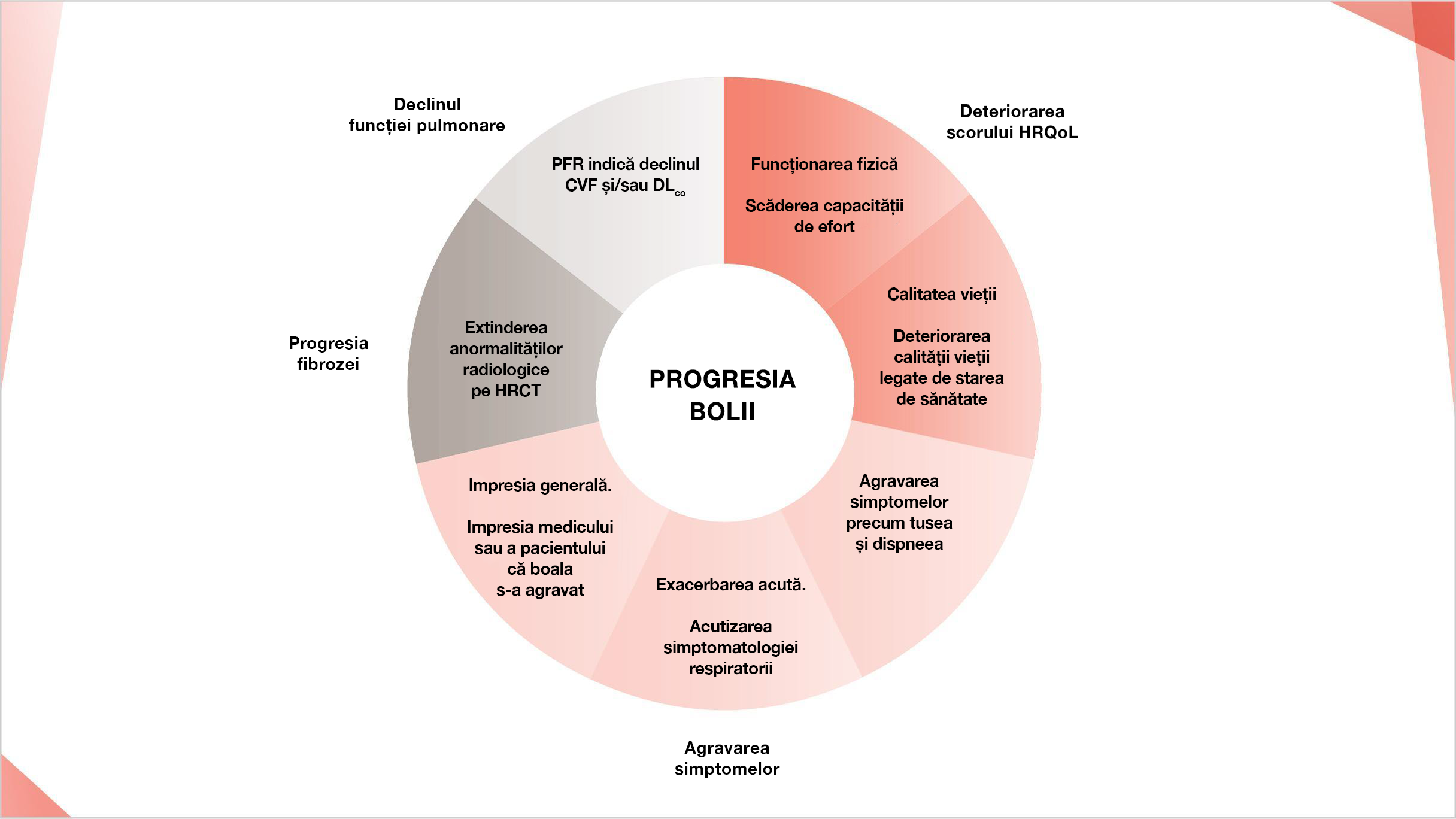
În PID, fenotipul fibrozant progresiv este definit prin prezența:2–5
Creșterii gradului de fibroză pe HRCT

Agravării simptomatologiei respiratorii

Declinului funcției pulmonare
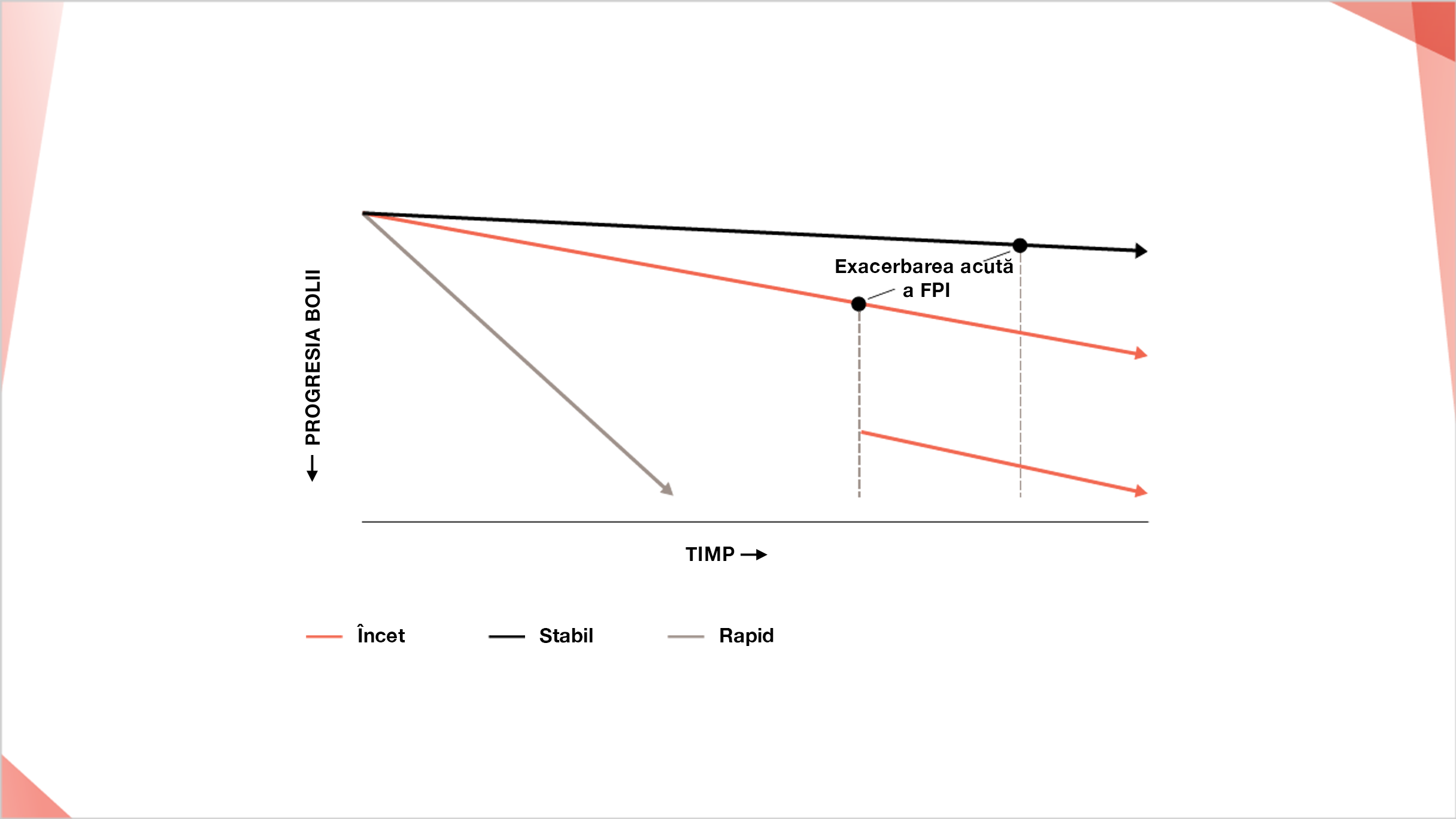
PROGRESIA FPI POATE FI RAPIDĂ DE LA MOMENTUL DIAGNOSTICULUI9
CE TIPURI DE PID POT DEZVOLTA UN FENOTIP FIBROZANT PROGRESIV?
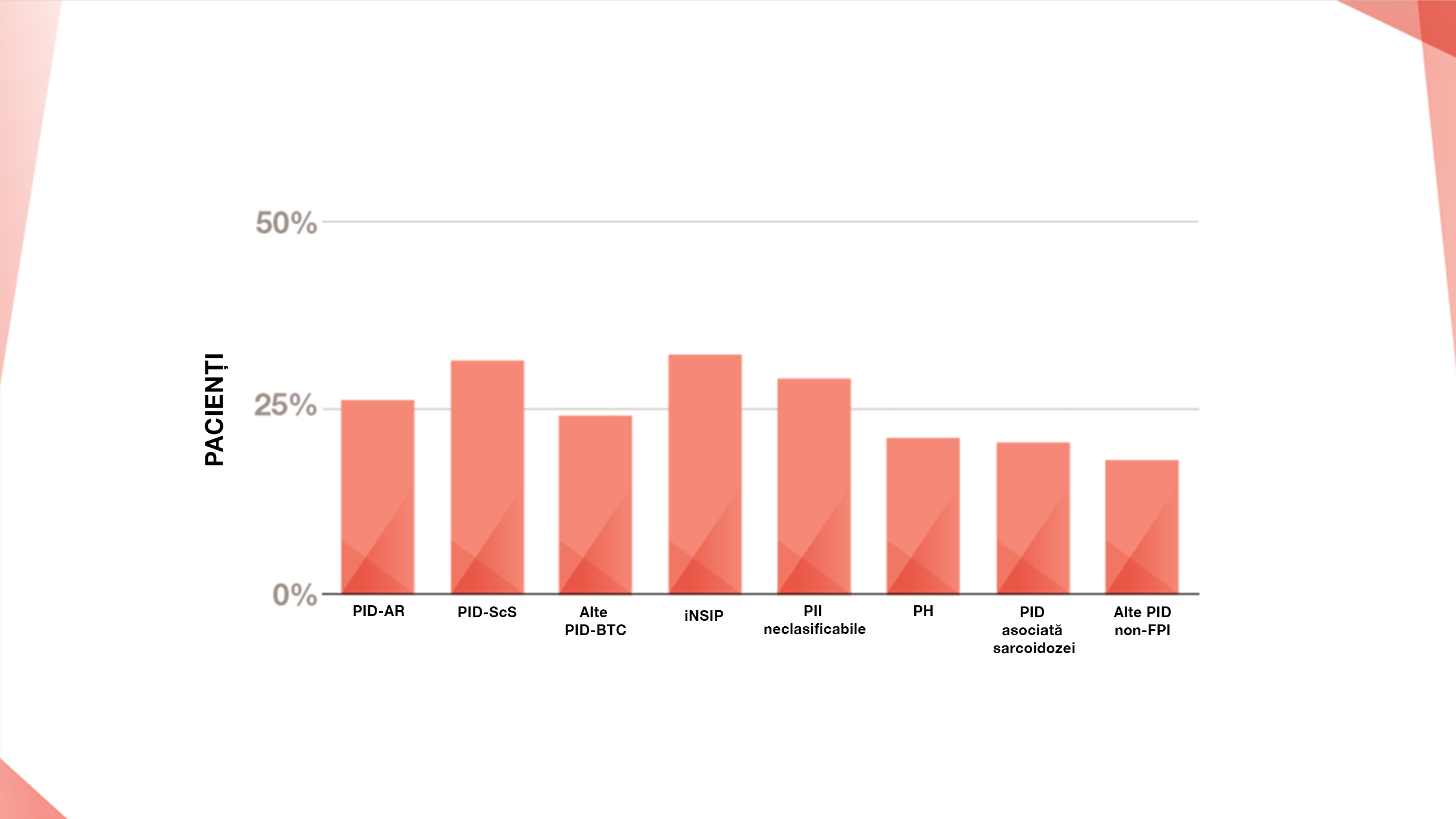
Tipuri de PID care pot fi asociate cu un fenotip fibrozant progresiv2,5
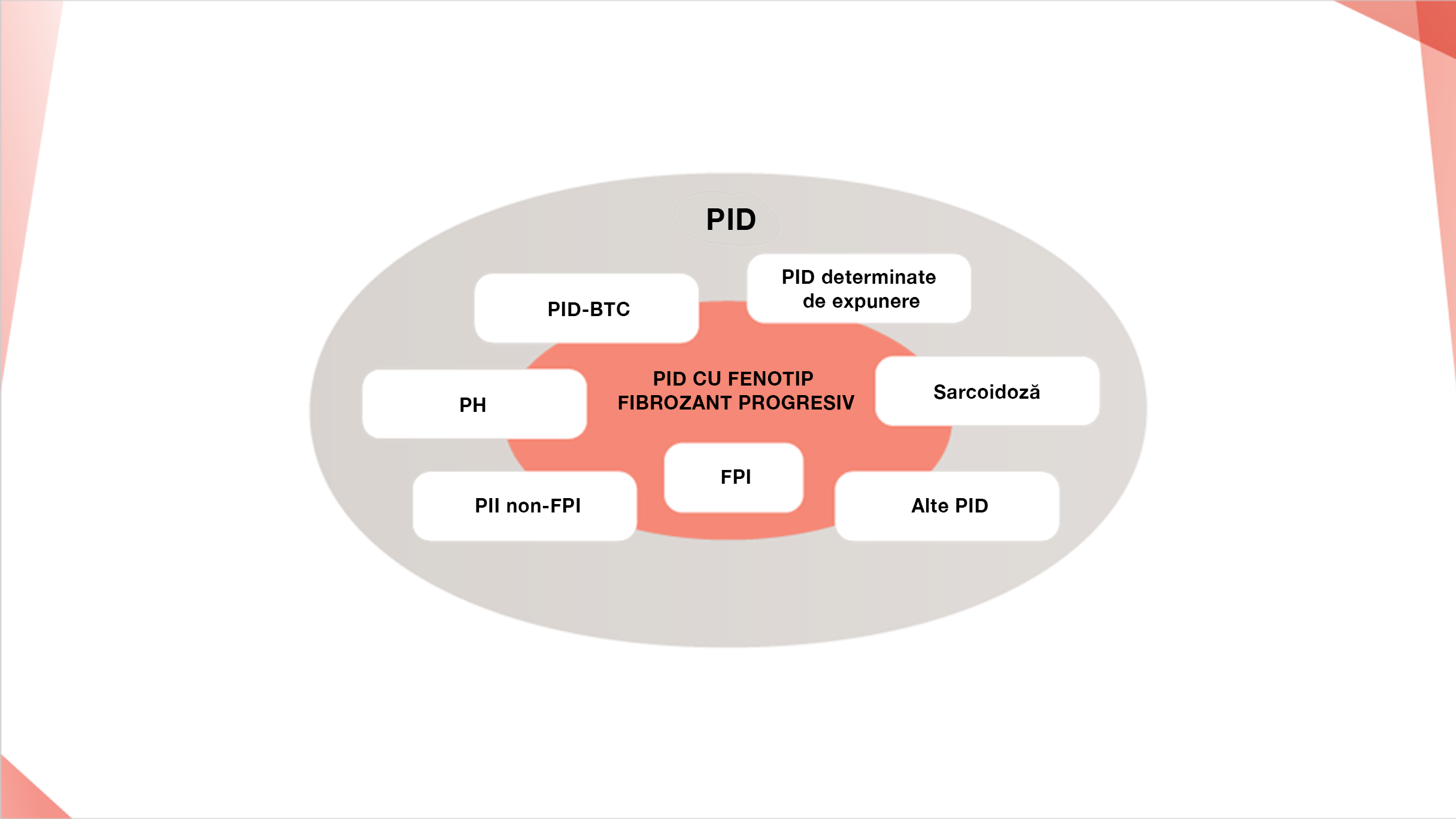
PREVALENȚA FENOTIPULUI FIBROZANT PROGRESIV LA PACIENȚII CU PID
POVARA PID CU FENOTIP FIBROZANT PROGRESIV POATE REDUCE SUBSTANȚIAL CALITATEA VIEȚII LEGATĂ DE STAREA DE SĂNĂTATE A PACIENTULUI3
La pacienții cu PID cu fenotip fibrozant progresiv, tusea, dispneea și oboseala limitează capacitatea fizică funcțională, precum și capacitatea de a efectua activități de bază și de a participa la viața de zi cu zi3,15–17

Tuse

Dispnee
Fatigabilitate
Pe lângă impactul funcțional, pacienții cu PID cu fenotip fibrozant progresiv pot prezenta suferințe emoționale, inclusiv sentimente de depresie, pierderea independenței și neputinţă.3,15,17–19
Depresie

Neputință

Pierderea independenței

Anxietate
Pacienții cu PID cu fenotip fibrozant progresiv, cum ar fi FPI, PH și PID-BTC, raportează simptome aproape universale de anxietate și/sau depresie.17,19
DESCOPERIȚI IMPACTUL COMPLET AL PID CU FENOTIP FIBROZANT PROGRESIV
Dr. Nazia Chaudhuri subliniază impactul fizic și emoțional al fenotipului fibrozant progresiv asupra pacienților și modul în care acesta se poate dezvolta în PID, indiferent de factorul declanșator subiacent
Primul pas pentru încetinirea PID cu fenotip fibrozant progresiv este identificarea pacienților
Monitorizare precoce și regulată

Intervenția în cazul PID
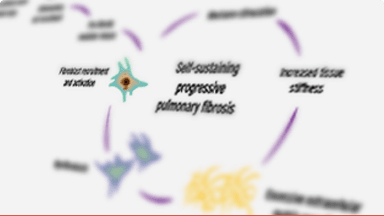
Patofiziologia PID cu fenotip fibrozant progresiv
Note
-
*
Date bazate pe sondaje online efectuat în rândul a 486 de medici.12
-
†
Pacienții diagnosticați cu PID, altele decât FPI.
-
‡
Fibroza progresivă a fost definită ca fiind o fibroză detectată prin HRCT (adică anomaliie reticulare cu bronșiectazii de tracțiune cu sau fără aspect de fagure de miere) care a fost progresivă în ceea ce privește agravarea funcției pulmonare (CVF și/sau DLCO) și/sau simptome respiratorii și/sau imagistică toracică.
-
§
Cercetare subvenționată de Boehringer Ingelheim.
-
¶
Estimări privind procentul de pacienți cu PID non-FPI care dezvoltă fibroză progresivă bazate pe un sondaj online efectuat în rândul a 486 de medici (243 de pneumologi, 203 de reumatologi și 40 de interniști) din Statele Unite, Japonia, Franța, Germania, Italia, Spania și Regatul Unit.
- Wijsenbeek M, Kreuter M, Fischer A, et al. Non-IPF progressive fibrosing interstitial lung disease (PF-ILD): the patient journey. Am J Respir Crit Care Med. 2018;197:1-2.
- Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
- Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076. Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
- Selman M, King TE, Pardo A; American Thoracic Society; European Respiratory Society; American College of Chest Physicians. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134(2):136–151.
- Bagnato G, Harari S. Cellular interactions in the pathogenesis of interstitial lung diseases. Eur Respir Rev. 2015;24(135):102–114.
- van Manen MJ, Geelhoed JJ, Tak NC, Wijsenbeek MS. Optimizing quality of life in patients with idiopathic pulmonary fibrosis. Ther Adv Respir Dis. 2017;11(3):157–169.
- Raghu G, Collard HR, Egan JJ, et al; on behalf of the ATS/ERS/JRS/ALAT Committee on Idiopathic Pulmonary Fibrosis. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788–824.
- Molina-Molina M, Aburto M, Acosta O, et al. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
- Vancheri C, Failla M, Crimi N, Raghu G. Idiopathic pulmonary fibrosis: a disease with similarities and links to cancer biology. Eur Respir J. 2010;35(3):496–504.
- Wijsenbeek MS, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019:1–10.
- Holtze C, Flaherty K, Kreuter M, et al. Healthcare utilisation and costs in the diagnosis and treatment of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180078.
- Olson AL, Gifford AH, Inase N, et al. The epidemiology of idiopathic pulmonary fibrosis and interstitial lung diseases at risk of a progressive-fibrosing phenotype. Eur Respir Rev. 2018;27(150):pii:180077.
- Swigris JJ, Brown KK, Abdulqawi R, et al. Patients’ perceptions and patient-reported outcomes in progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180075.
- Olson AL, Brown KK, Swigris JJ. Understanding and optimizing health-related quality of life and physical functional capacity in idiopathic pulmonary fibrosis. Patient Relat Outcome Meas. 2016;7:29-35.
- Morisset J, Dubé B, Garvey C, et al. The Unmet Educational Needs of Patients with Interstitial Lung Disease: Setting the Stage for Tailored Pulmonary Rehabilitation. Ann Am Thorac Soc. 2016;13:1026–1033.
- Duck A, Spencer LG, Bailey S, et al. Perceptions, experiences and needs of patients with idiopathic pulmonary fibrosis. J Adv Nurs. 2014;71(5):1055-1065.
- Hinz A, Brähler E, Möde R, et al. Anxiety and depression in sarcoidosis: the influence of age, gender, affected organs, concomitant diseases and dyspnoea. Sarcoidosis Vasc Diffuse Lung Dis. 2012;29(2):139-146.
- Wuyts WA, Agostini C, Antoniou KM, et al. The pathogenesis of pulmonary fibrosis: a moving target. Eur Respir J. 2013;41(5):1207–1218.