Progresia și mecanismul de auto-întreținere al fibrozei în PID-BTC
Pneumopatiile interstițiale difuze asociate bolilor de țesut conjunctiv (PID-BTC) pot avea mecanisme comune de auto-întreținere ale fibrozei pulmonare progresive1,2

MECANISMUL NATURAL DE AUTO-ÎNTREȚINERE A FIBROZEI PROGRESIVE
Căile patogenice comune ale fibrozei pulmonare în PID-BTC
Aflați despre mecanismele fiziopatologice aplicabile unei game largi de PID-BTC fibrozante care pot dezvolta un fenotip fibrozant progresiv
Progresia auto-întreținută a fibrozei3-5
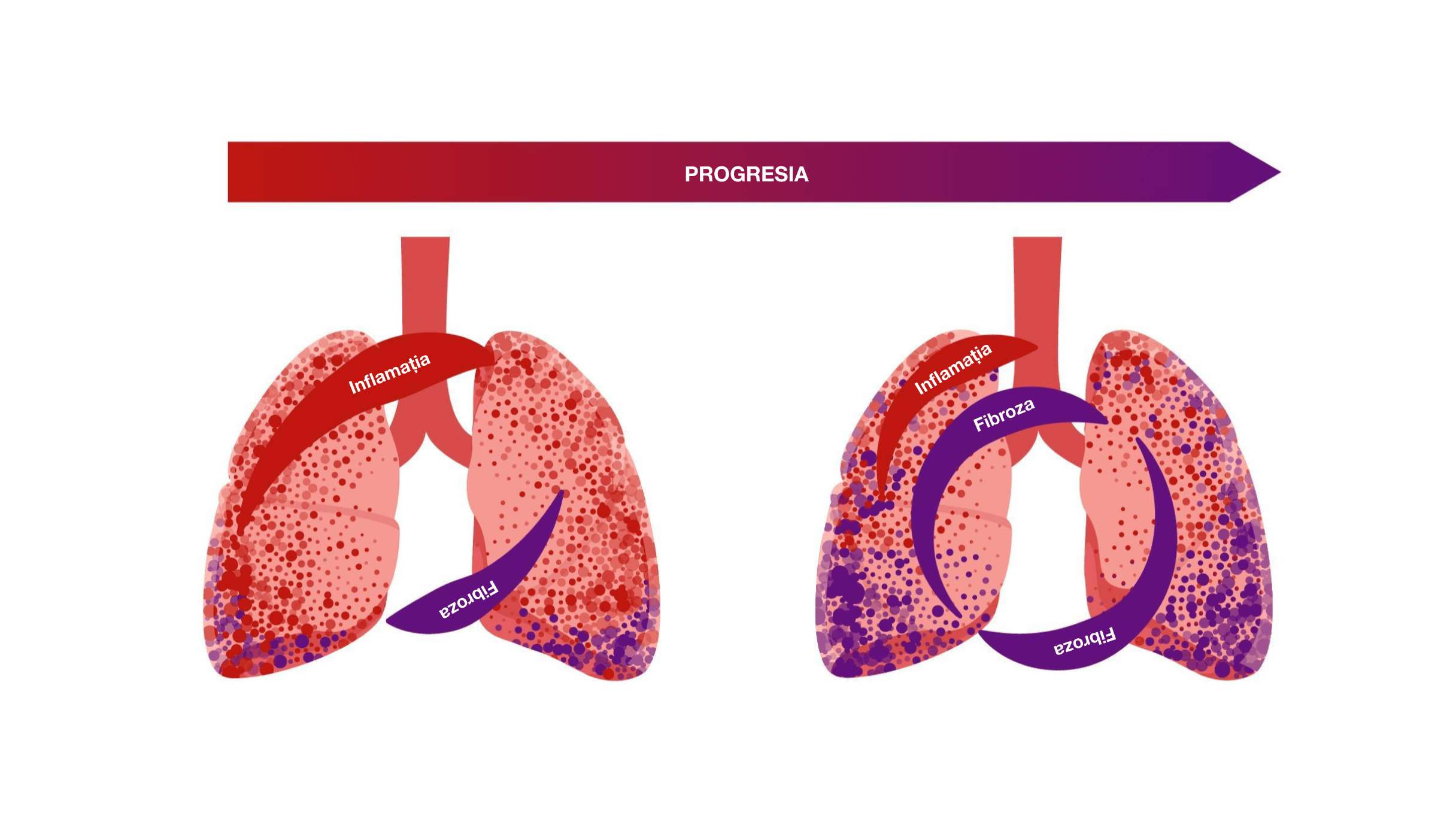
Indiferent de diagnosticul clinic, există elemente comune în mecanismele patogenice care determină un proces de auto-întreținere a fibrozei pulmonare.2
Secreția excesivă de matrice extracelulară poate duce la un proces de auto-întreținere a fibrozei progresive, în care rigiditatea tisulară crescută și eliberarea de citokine profibrotice activează în continuare fibroblaștii1.
Într-o buclă de tip feed-forward, rigiditatea tisulară pulmonară crescută activează și stimulează și mai mult fibroblaștii ceea ce determină un proces auto-întreținut de fibroză6,7
Odată ce fibroza pulmonară se auto-întreține, fibroblaștii pot deveni parțial independenți de stimularea externă și de răspunsul inflamator inițial8-10.
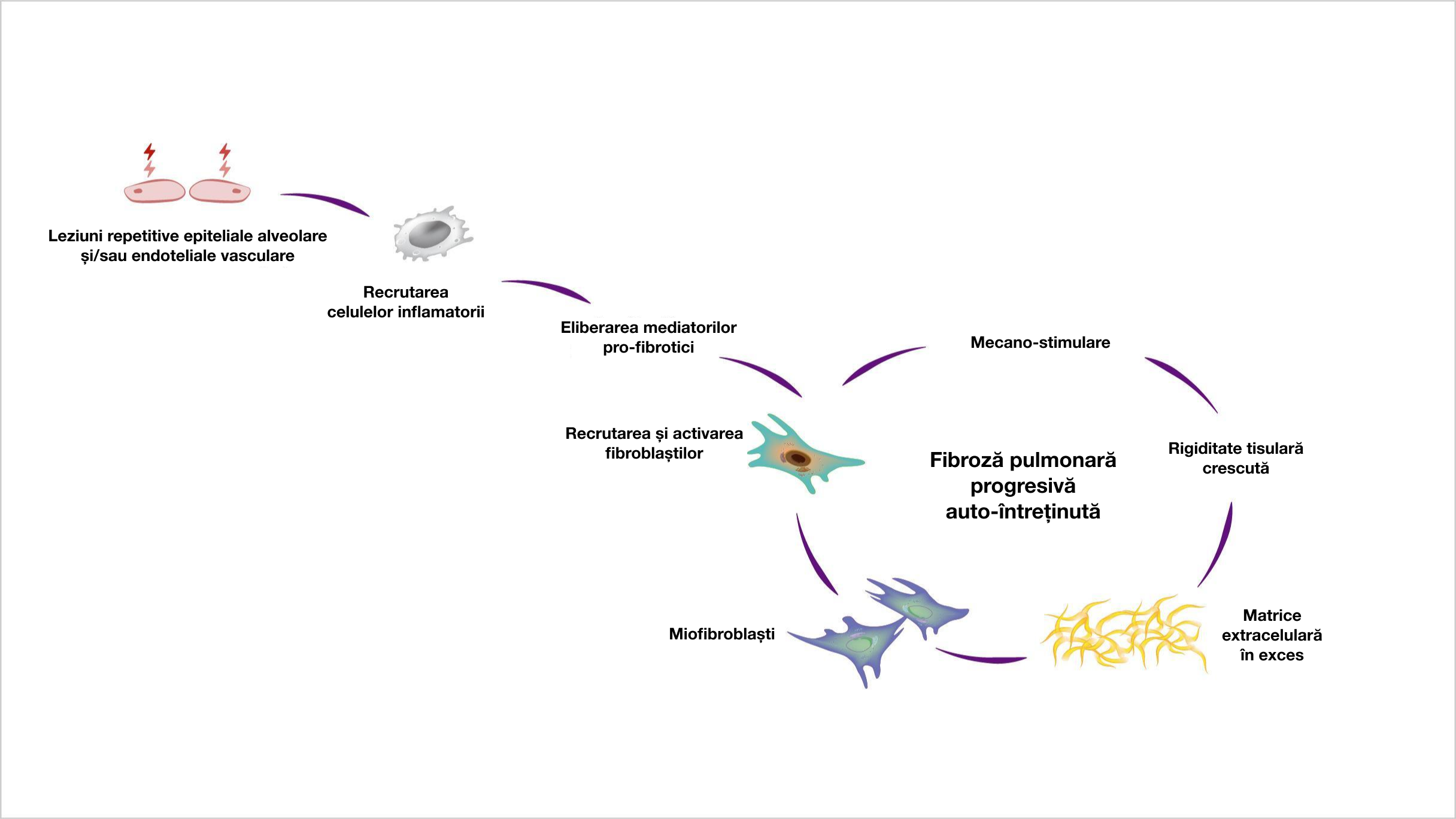
Adaptat după: Wollin L, et al. Eur Respir J. 2019;54:1900161.4
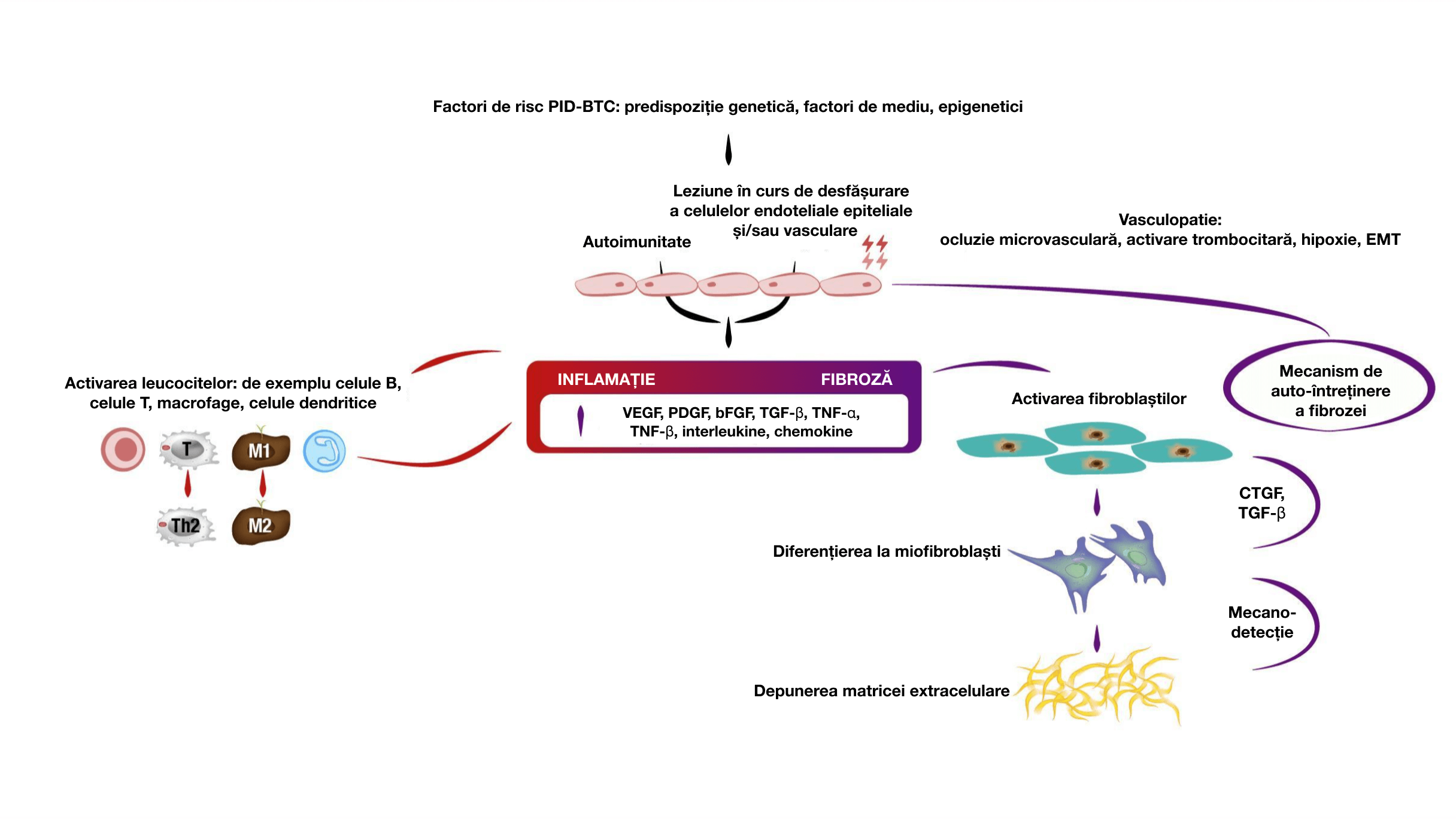
Mecanismele de auto-întreținere din spatele fibrozei în patogeneza PID-BTC1,5,11-18
Cum puteți monitoriza și trata progresia fibrozei la pacienții cu PID-BTC?
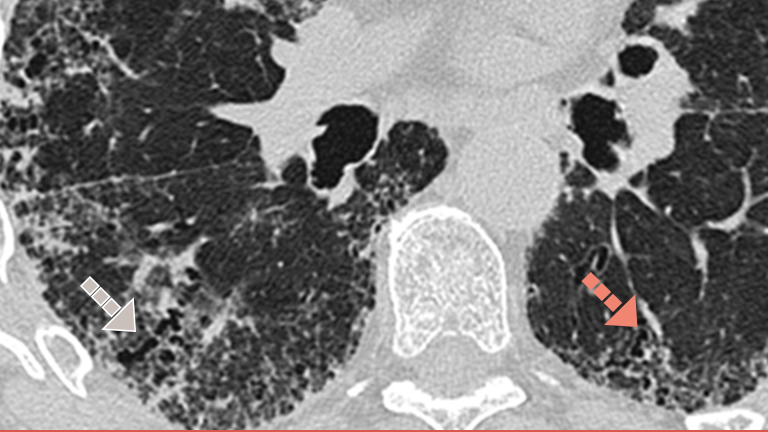
Investigarea PID-BTC fibrozante cu ajutorul imagisticii HRCT

Monitorizarea precoce și regulată a progresiei PID în PID-BTC

Managementul PID-BTC cu fenotip fibrozant progresiv
Note
bFGF, factor bazal de creștere al fibroblaștilor; BTC, boli ale țesutului conjunctiv; PID-BTC, pneumopatie interstițială difuză asociată cu boli ale țesutului conjunctiv; CTGF, factor de creștere al țesutului conjunctiv; EMT, tranziție epitelial-mezenchimală; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză; MMP, metaloproteinaza matricei celulare; PDGF, factor de creștere derivat plachetar; PFR, probe funcționale respiratorii; PID-AR pneumopatie interstițială difuză asociată artritei reumatoide; TGF-p, factor de creștere transformator-p; TNF-α, factor de necroză tumorală-α; TNF-p, factor de necroză tumorală-p; VEGF, factor de creștere a endoteliului vascular.
- Fischer A and Distler J. Progressive fibrosing interstitial lung disease associated with systemic autoimmune diseases. Clin Rheumatol. 2019;38(10):2673–2681.
- Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
- Saketkoo LA, Scholand MB, Lammi MR, et al. Patient-reported outcome measures in systemic sclerosis–related interstitial lung disease for clinical practice and clinical trials. Scleroderma Relat Disord. 2020;5(2 Suppl): 48–60.
- Wollin L, Distler JHW, Redente EF, et al. Potential of nintedanib in treatment of progressive fibrosing interstitial lung diseases. Eur Respir J. 2019;54(3):1900161. doi: 10.1183/13993003.00161-2019.
- Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10:728–739.
- Huang X, Yang N, Fiore VF, et al. Matrix stiffness-induced myofibroblast differentiation is mediated by intrinsic mechanotransduction. Am J Respir Cell Mol Biol. 2012;47(3):340–348.
- Froese AR, Shimbori C, Ballaye PS, et al. Stretch-induced Activation of Transforming Growth Factor-β1 in Pulmonary Fibrosis. Am J Respir Crit Care Med. 2016;194(1):84–96.
- Distler J, et al. Shared and distinct mechanisms of fibrosis. Nat Rev Rheumatol 2019(b):15:705–30.
- Kolb M, Flaherty KR. The justification for the progressive fibrotic phenotype. Curr Opin Pulm Med 2021; online ahead of print.
- Leask A. The hard problem: Mechanotransduction perpetuates the myofibroblast phenotype in scleroderma fibrosis. Wound Rep Reg. 2021;29:582–587.
- Cutolo M, Soldano S, Smith V. Pathophysiology of systemic sclerosis: current understanding and new insights. Exp Rev Clin Immunol. 2019;15:753–764.
- Khanna D, Tashkin DP, Denton CP, et al. Etiology, Risk Factors, and Biomarkers in Systemic Sclerosis with Interstitial Lung Disease. Am J Respir Crit Care Med. 2019; doi: 10.1164/rccm.201903-0563CI.
- Shaw M, Collins BF, Ho LA, Raghu G. Rheumatoid arthritis-associated lung disease. Eur Respir Rev. 2015;24(135):1–16.
- Cavagna L, Monti S, Grosso V, et al. The multifaceted aspects of interstitial lung disease in rheumatoid arthritis. Biomed Res Int. 2013;2013:759760. doi: 10.1155/2013/759760.
- Varga J, Abraham D. Systemic sclerosis: a prototypic multisystem fibrotic disorder. J Clin Invest. 2007;117:557-567.
- Bagnato G, Harari S. Cellular interactions in the pathogenesis of interstitial lung diseases. Eur Respir Rev. 2015;24(135):102–114.
- Nicolosi P A, Tombetti E, Maugeri N, et al. Vascular Remodelling and Mesenchymal Transition in Systemic Sclerosis. Stem Cell Int. 2016; doi: 10.1155/2016/4636859.
- Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: a doubleblind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res. 2017;4(1):e000212. doi: 10.1136/bmjresp-2017-000212.
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Selman M, King TE, Pardo A; American Thoracic Society; European Respiratory Society; American College of Chest Physicians. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134(2):136–151.
- Geerts S, Wuyts W, De Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Diffuse Lung Dis. 2017;34(4):326–335.
- Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
- Chowaniec M, Skoczyńska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
- Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
