Diagnosticul
PID-BTC
Tomografia computerizată de înaltă rezoluție (HRCT) combinată cu discuțiile multidisciplinare pot permite diagnosticarea certă a pneumopatiei interstițiale difuze (PID) în bolile țesutului conjunctiv (BTC)1–3

HRCT ESTE STANDARDUL DE AUR PENTRU A DIAGNOSTICA SAU A EXCLUDE PID1,2
PFR TREBUIE EFECTUATE LA PACIENȚI CU SIMPTOME INEXPLICABILE SAU LA CONSTATĂRILE EXAMINĂRII FIZICE CARE SUNT CONSISTENTE CU PID1,4
PID se caracterizează prin PFR care prezintă fiziologie pulmonară restrictivă și DLco afectat2
Un PFR normal poate indica prezența PID dacă măsurătorile anterioare au arătat valori peste normal, ilustrând importanța comparației cu testele anterioare1
DLCO redusă este adesea prima manifestare fiziopatologică a PID, în timp ce un defect ventilator restrictiv, cu CVF și CPT reduse proporțional, este caracteristic unei boli mai avansate1,4.
Testele cardio-pulmonare de efort (CPET) pot fi utile în PID-BTC pentru a determina dacă dispneea este cauzată în primul rând de PID, boala vasculară pulmonară, boala cardiacă sau altă etiologie5
CUM PERCEP PACIENȚII CU BTC SIMPTOMELE PULMONARE?
Conștientizarea limbajului pacientului poate ajuta la identificarea simptomelor PID în BTC6
Pacienții cu PID se referă rareori la actul propriu-zis de a respira, dar dificultățile de respirație sunt indicate de capacitatea de a efectua activități esențiale pentru funcționalitatea sau prioritățile vieții6.
Pacienții cu PID descriu relația dintre tuse și dispnee - cu tusea rezultată din activități care necesită un inspi profund și tusea care exacerbează la rândul ei dispneea6
Limbajul pacientului poate ajuta la identificarea dispneei (respirație legată de activități care duc la dificultăți de respirație și senzație de constricție toracică) pe baza fatigabilității6
CARE SUNT ATRIBUTELE COMUNE PENTRU SIMPTOMELE PULMONARE ALE PID-BTC?
Descriptorii obișnuiți pentru „respirație scurtă” sau „lipsă de aer” și senzații inconfortabile legate de inspirație, utilizați de pacienții cu PID-BTC6
Descriptorii tradiționali, cum ar fi „scurtarea respirației” sau „lipsa de aer” au fost rar exprimate. În schimb s-au folosit sintagme precum cele din figura
de mai jos5
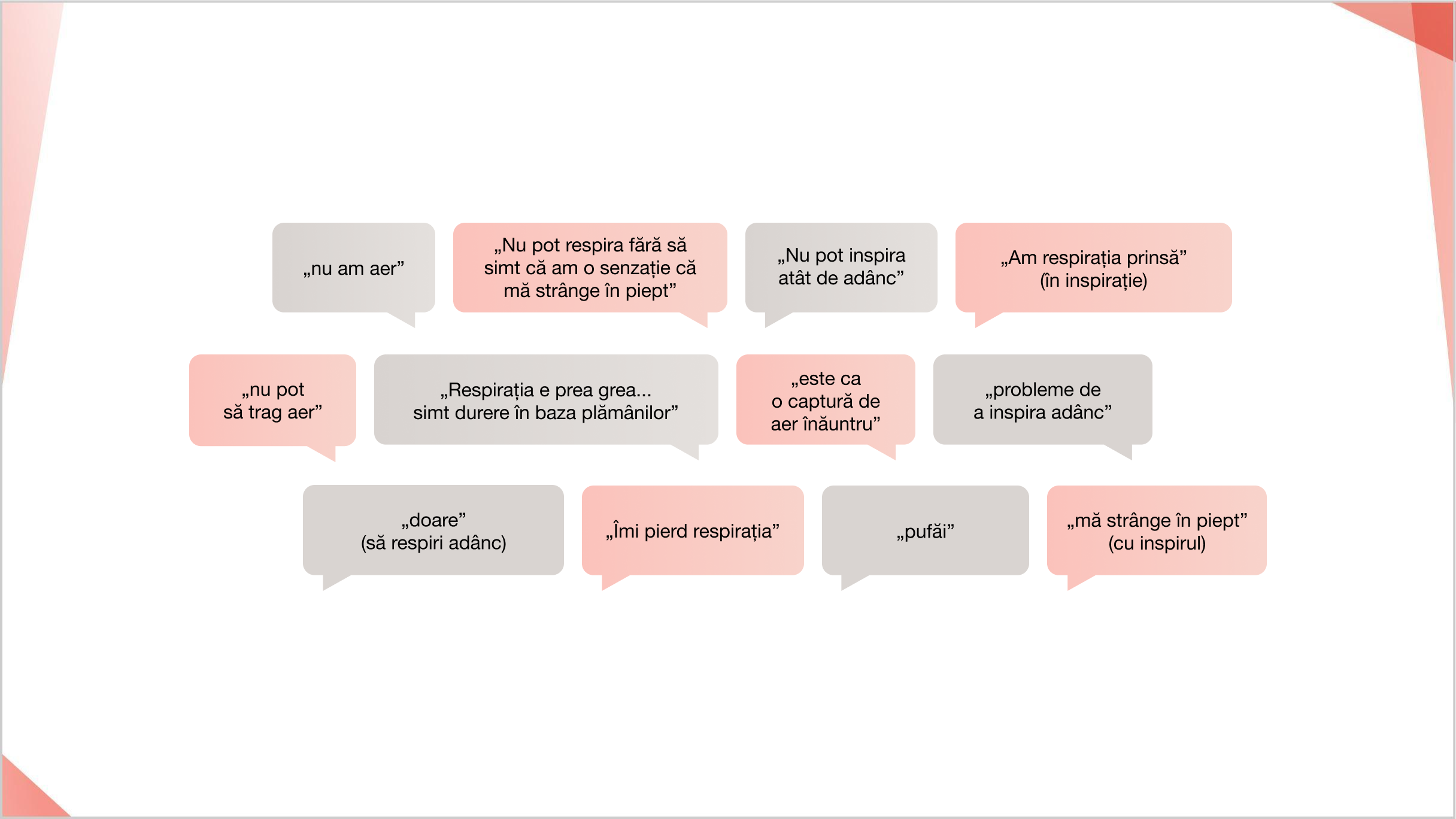
Sondaj a 6 focus grupuri multicentrice, incluzând 45 de pacienți cu PID-BTC (PID-IIM (n=11, PID-AR (n=l3), PID-ScS (n=17)) și diverse alte diagnostice BTC (n=4))6.
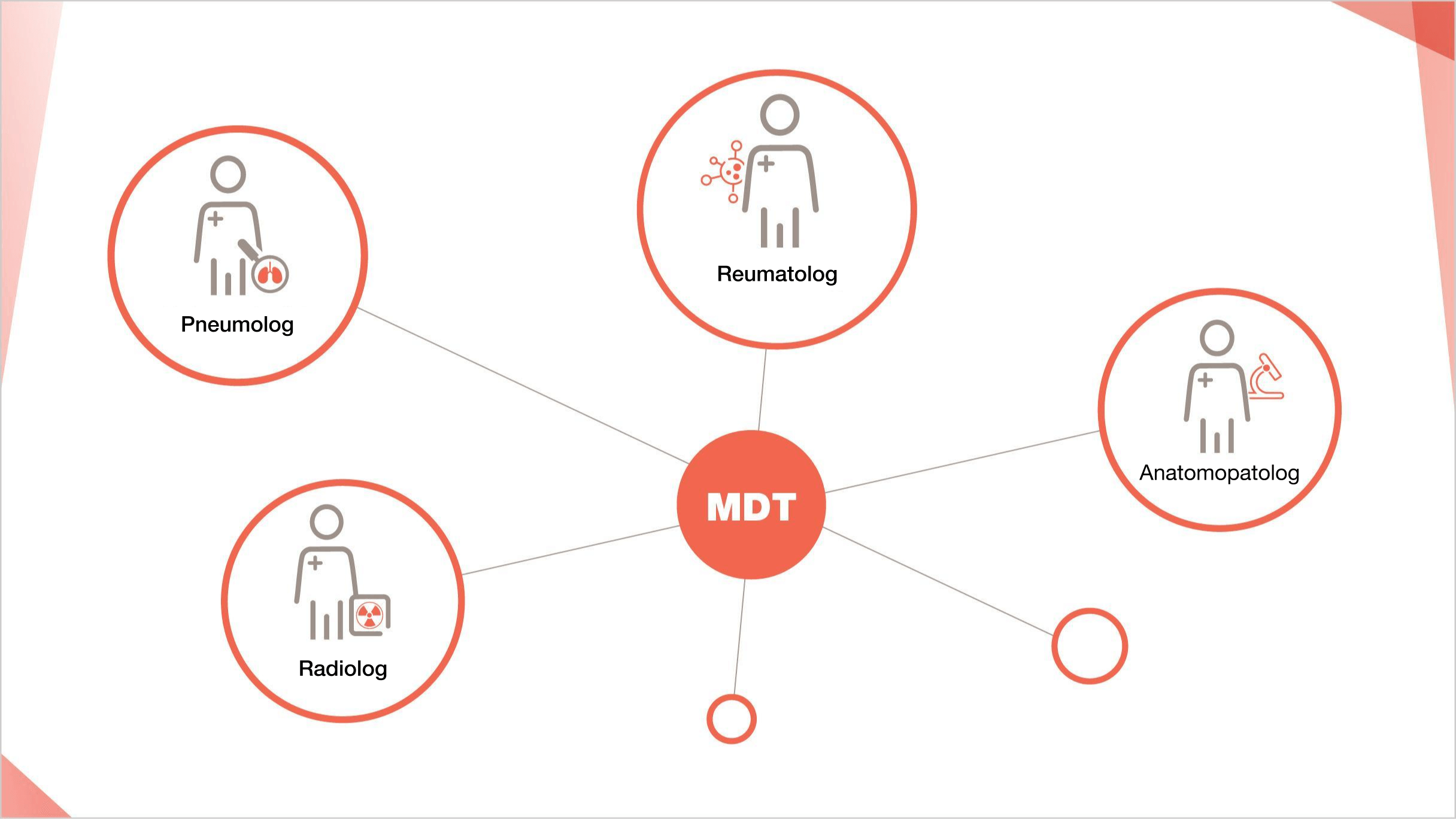
Diagnosticul multidisciplinar este asociat cu niveluri mai ridicate de încredere în diagnostic și cu un acord mai bun între observatori prin comparație cu rolurile individuale izolate3
În cazurile în care un MDT este dificil de reunit pentru un pacient cu PID, discuțiile multidisciplinare pot fi purtate virtual sau prin telefon pentru a permite fiecărui grup de specialitate să contribuie8
Aflați cum să colaboreze în mod proactiv o echipă MDT pentru diagnosticarea PID

HRCT este metoda standard de aur pentru diagnosticul non-invaziv al PID-ScS9
Cum puteți diagnostica PID la pacienții dumneavoastră cu ScS?

HRCT combinată cu evaluarea multidisciplinară oferă o încredere ridicată în diagnosticul PID la pacienții cu AR10-12
Cum puteți diagnostica PID la pacienții dumneavoastră cu AR?

HRCT combinată cu evaluarea multidisciplinară mărește acuratețea diagnosticului PID la pacienții cu sindrom Sjögren primar13-17
Cum puteți diagnostica PID la pacienții dumneavoastră cu sindrom Sjögren primar?
Odată ce a fost atins un diagnostic PID-BTC, cum ar trebui să gestionați pacientul?

Monitorizarea precoce și regulată a progresiei PID în PID-BTC

Managementul PID-BTC cu fibroza progresivă

Oferirea de îngrijiri paliative/ de susținere
Note
-
CCP peptidă citrulinată ciclică; BTC, boala țesutului conjunctiv, PID-BTC, pneumopatie interstițială difuză – asociată bolilor de țesut conjunctiv; CxR, radiografie toracică; DLCO, factorul de transfer gazos pentru monoxidul de carbon; CVF, capacitatea vitală forțată; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză; NSIP, pneumopatie interstițială nespecifică; PFR, probe funcționale pulmonare, AR, artrită reumatoidă; PID-AR, pneumopatie interstițială difuză asociată cu artrita reumatoidă; PID-ScS, pneumopatie interstițială difuză asociată sclerozei sistemice.
Geerts S, Wuyts W, Langhe ED, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Dif. 2017;34:326–335.
Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
Walsh SLF. Multidisciplinary evaluation of interstitial lung diseases: current insights. Eur Respir Rev. 2017;26:170002.
Spagnolo P, Cordier JF, Cottin V. Connective tissue diseases, multimorbidity and the ageing lung. Eur Respir J. 2016;47(5):1535–1558.
Assayag D, Ryerson CJ. Determining respiratory impairment in connective tissue disease-associated interstitial lung disease. Rheum Dis Clin North Am. 2015;41(2):213–23.
Mittoo S, Frankel S, LeSage D, et al. Patient perspectives in OMERACT provide an anchor for future metric development and improved approaches to healthcare delivery in connective tissue disease related interstitial lung disease (CTD-ILD). Curr Respir Med Rev. 2015;11(2):175–183.
Dellaripa PF. Interstitial lung disease in the connective tissue diseases; a paradigm shift in diagnosis and treatment. Clin Immunol. 2018;186:71–73.
- Chung JH, Goldin JG. Interpretation of HRCT Scans in the Diagnosis of IPF: Improving Communication Between Pulmonologists and Radiologists. Lung. 2018;196:561–567.
- Chowaniec M, Skoczyńska M, Sokolik R, et al. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56, 249–254.
- Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082.
- Iqbal K and Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
- Kawano-Dourado L, Doyle TJ, Bonfiglioli K, et al. Baseline characteristics and progression of a spectrum of interstitial lung abnormalities and disease in rheumatoid arthritis. Chest. 2020:S0012-3692(20)31412-4. doi:10.1016/j.chest.2020.04.061.
- Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10(12):728–739.
- Luppi F, Sebastiani M, Sverzellati N, Cavazza A, Salvarani C, Manfredi A. Lung complications of Sjogren syndrome. Eur Respir Rev. 2020;29(157):200021.
- Flament T, Bigot A, Chaigne B, Henique H, Diot E, Marchand-Adam S. Pulmonary manifestations of Sjögren’s syndrome. Eur Respir Rev. 2016;25(140):110–123.
- Manfredi A, Sebastiani M, Cerri S, et al. Prevalence and characterization of non-sicca onset primary Sjögren syndrome with interstitial lung involvement. Clin Rheumatol. 2017;36(6):1261–1268.
- Lee AS, Scofield RH, Hammitt KM, et al. Consensus guidelines for evaluation and management of pulmonary disease in Sjögren’s. Chest. 2020 Oct 20. doi: 10.1016/j.chest.2020.10.011.
- Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
- Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
- Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
- Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
- Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
