Screeningul pentru PID în SSp
În timp ce toți pacienții cu sindromul Sjögren primar (SSp) sunt expuși riscului de a dezvolta pneumopatie interstițială difuză (PID) și ar trebui să fie examinați la diagnosticul inițial de SSp, metoda de screening depinde de simptomele respiratorii

PACIENȚII SSp CU RISC DE PID TREBUIE VERIFICAȚI SISTEMATIC1,2

Fumatul crește riscul de PID de peste 8 ori (OR 8,55, IC 95% 1,09–67,19, p=0,040) la pacienții cu SSp, dar este important de menționat că PID-SSp poate apărea la nefumători8

Pacienții cu SSp cu PID au niveluri mai mari de indicatori de activitate a bolii, cum ar fi indicele de activitate a bolii cu sindromul Sjögren EULAR, VSH și CRP, comparativ cu cei fără PID8,9.
Aflați cum să identificați semnele și simptomele SSp la pacienții dvs
PACIENȚII SSp TREBUIE SĂ FIE EXAMINAȚI SISTEMATIC LA MOMENTUL INIȚIAL PENTRU INTERESAREA PULMONARĂ, MAI ALES DACĂ AU SIMPTOME PULMONARE PRE-EXISTENTE1,2
Scanările PFR și HRCT trebuie efectuate la pacienții nou diagnosticați cu SSp care se confruntă cu tuse cronică și/sau dispnee.1 Pacienții cu SSp sunt expuși riscului de PID și ar trebui să fie examinați sistematic2,6
Un consens de experți din 2020 recomandă insistent ca medicii să obțină un istoric medical detaliat care să se întrebe despre simptomele respiratorii la toți pacienții cu SSp la prima vizită și la fiecare vizită ulterioară1
Ascultarea ralurilor bibazilare fine, de tip crepitante la auscultația pulmonară poate fi un screening util pentru PID subclinic la pacienții cu SSp, iar prezența lor ar trebui să invite o evaluare completă a funcției pulmonare12
Algoritm sugerat din ghidurile consensuale pentru screening-ul și identificarea PID la pacienții cu SSp1
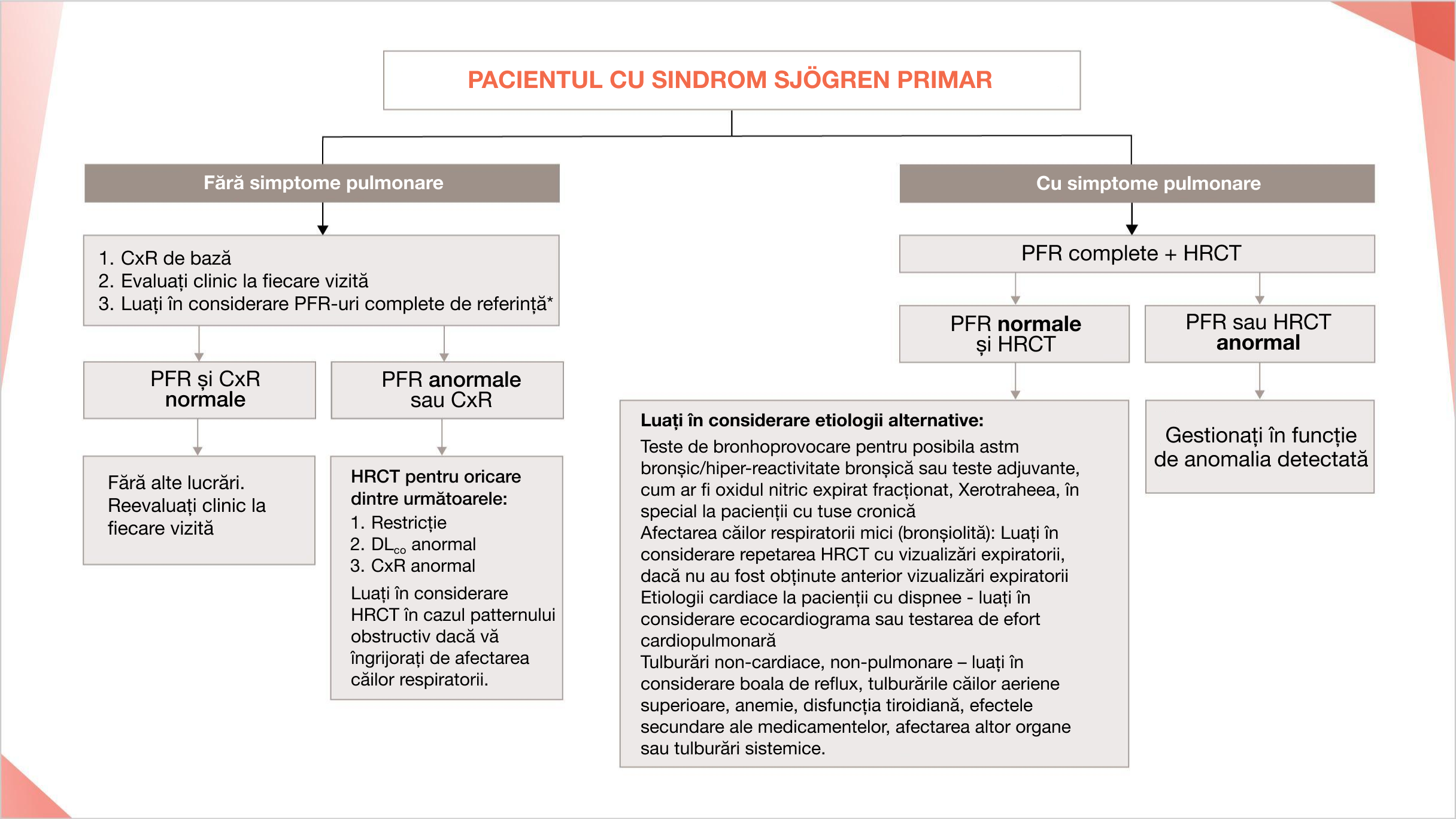
* Beneficiul obținerii de PFR de bază la pacienții asimptomatici cu SSp în ceea ce privește rezultatele pe termen lung nu este clar. Această lipsă de dovezi și costurile potențiale ale testului ar trebui să fie luate în considerare și discutate cu pacienții individuali înainte de a continua cu screeningul PFR.
PFR complete includ spirometrie, DLCO, volume pulmonare, măsurate în mod ideal prin pletismografie corporală
Adaptat după: Lee AS, et al. Chest. 2020 Oct 20. doi: 10.1016/j.chest.2020.10.011.
Odată ce ați ajuns la un diagnostic, cum ar trebui să faceți managementul pacienților cu PID-SSp?

Monitorizarea și managementul progresiei PID în PID-SSp

Oferirea de îngrijiri paliative/ de susținere
Echipa multidisciplinară
Note
-
ANA, anticorp antinuclear; CA125; cancer antigen 125; CA15-3, cancer antigen 15-3; CEA, antigen carcinoembrionar; CI, interval de încredere; CRP, proteină C-reactivă; PID-BTC pneumopatie interstițială difuză asociată cu boli ale țesutului conjunctiv; CxR, radiografie toracică; DLCO, factorul de transfer gazos pentru monoxid de carbon; VSH, viteza de sedimentare a eritrocitelor; EULAR, Liga Europeană Împotriva Reumatismului; CVF, capacitate vitală forțată; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză; NSE, enolază specifică neuronală; OR, odds ratio; PFR, probe funcționale respiratorii; SSp, sindromul Sjögren primar; SSp-ILD, pneumopatie interstițială difuză asociată sindromului Sjögren primar.
- Lee AS, Scofield RH, Hammitt KM, et al. Consensus guidelines for evaluation and management of pulmonary disease in Sjögren’s. Chest. 2020 Oct 20. doi: 10.1016/j. chest.2020.10.011.
- Flament T, Bigot A, Chaigne B, Henique H, Diot E, Marchand-Adam S. Pulmonary manifestations of Sjögren’s syndrome. Eur Respir Rev. 2016;25(140):110–123.
- Watanabe M, Naniwa T, Hara M, et al. Pulmonary manifestations in Sjögren’s syndrome: correlation analysis between chest computed tomographic findings and clinical subsets with poor prognosis in 80 patients. J Rheumatol. 2010;37(2):365–373.
- Sambataro G, Ferro F, Orlandi M, et al. Clinical, morphological features and prognostic factors associated with interstitial lung disease in primary Sjögren’s syndrome: A systematic review from the Italian Society of Rheumatology. Autoimmun Rev. 2020;19(2):102447.
- Ramos-Casals M, Brito-Zerón P, Seror R, et al. Characterization of systemic disease in primary Sjögren’s syndrome: EULAR-SS Task Force recommendations for articular, cutaneous, pulmonary and renal involvements. Rheumatology (Oxford). 2015;54(12):2230–2238.
- Roca F, Dominique S, Schmidt J, et al. Interstitial lung disease in primary Sjögren’s syndrome. Autoimmun Rev. 2017;16(1):48–54.
- Sogkas G, Hirsch S, Olsson KM, et al. Lung involvement in primary Sjögren’s syndrome—an under-diagnosed entity. Front Med (Lausanne). 2020;7:332.
- Wang Y, Hou Z, Qiu M, Ye Q. Risk factors for primary Sjögren syndrome-associated interstitial lung disease. J Thorac Dis. 2018;10(4):2108–2117.
- Shi L, Han X-L, Guo H-X, et al. Increased in tumor markers are associated with primary Sjögren’s syndrome-associated interstitial lung disease. Ther Adv Chronic Dis. 2020 Jul 30;11:2040622320944802. doi: 10.1177/2040622320944802.
- Nannini C, Jebakumar AJ, Crowson CS, et al. Primary Sjögren’s syndrome 1976–2005 and associated interstitial lung disease: a population-based study of incidence and mortality. BMJ Open. 2013;3(11):e003569.
- Guisado-Vasco P, Silva M, Duarte-Millán M A, et al. Quantitative assessment of interstitial lung disease in Sjögren’s syndrome. PLoS One. 2019;14(11):e0224772.
- Luppi F, Sebastiani M, Sverzellati N, Cavazza A, Salvarani C, Manfredi A. Lung complications of Sjogren syndrome. Eur Respir Rev. 2020;29(157):200021.
- Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
- Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
- Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
- Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.

