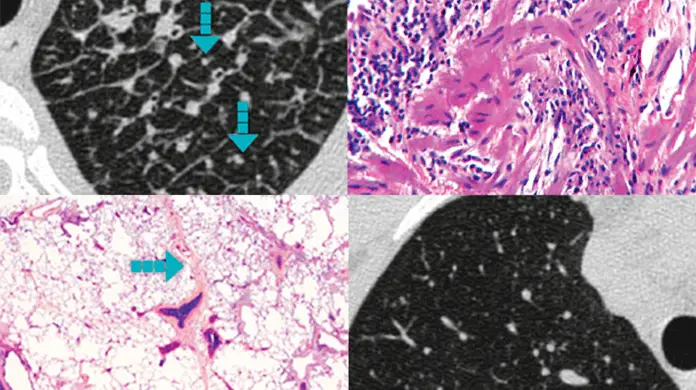
Imagistica HRCT a fibrozei pulmonare în PID-BTC
Tomografia computerizată de înaltă rezoluție (HRCT) este standardul de aur pentru diagnosticul precis al bolii pulmonare interstițiale (PID) în bolile țesutului conjunctiv (BTC)1,2

LA PACIENȚII CU SUSPICIUNE DE PID, UTILIZAREA HRCT TORACIC ESTE ESENȚIALĂ1
HRCT este standardul de aur pentru a diagnostica sau exclude în mod clar PID1,2. Amploarea fibrozei la HRCT sugerează un prognostic prost în mai multe subtipuri PID-BTC și poate oferi dovezi suplimentare de stabilitate sau agravare la pacienții cu dovezi neclare de progresie.1
Ce factori de risc indică un prognostic prost și o mortalitate precoce în cazul pID-BTC?
Screening-ul pentru PID-BTC poate avea dublul beneficiu de a identifica boala în stadiu incipient și mai precis de a identifica pacienții cu cel mai mare risc de progresie și declin funcțional6
RADIOLOGUL ARE UN ROL CENTRAL ÎN DIAGNOSTICUL PID-BTC ÎN COLABORARE CU UN REUMATOLOG7
Istoricul clinic al pacienţilor cu BTC îl poate ajuta pe radiolog în:8
contribuția la discuțiile în echipa multidisciplinară
Interpretarea caracteristicilor radiologice pe scanările HRCT
Oferirea de informații valoroase pentru a face un diagnostic diferențial de suspiciune de PID
Caracteristicile radiografice tipice ale HRCT care indică fibroza în PID-BTC includ:12,13
Bronșiectazie de tip tracțiune, cu sau fără opacități cu aspect de tip sticlă mată
Reticulații, cu sau fără opacități de sticlă mată
Fagure de miere, cu sau fără opacități de sticlă mată
Lexicon de fundal al modelelor HRCT:
- pneumopatia predominant uzuală (UIP) este caracterizată printr-un model radiografic mai puțin omogen, modificare relativă a arhitecturii pulmonare, severitate variabilă a leziunilor fibrotice, formarea predominantă bazilară și reticulație subpleurală cu bronșiectazii de tracțiune12,13
- pneumopatia interstițială nespecifică (NSIP) este caracterizată printr-un model radiografic mai omogen, conservarea relativă a arhitecturii pulmonare și opacități relativ simetrice subpleurale cu aspect de sticlă mată cu evitare subpleurală adiacentă12,13
- pneumopatia interstițială limfoidă (LIP) este caracterizată prin chisturi împrăștiate cu pereți subțiri și opacificări cu aspect de sticlă mată12
Majoritatea pacienților cu PID-ScS au un model fibrotic NSIP pe HRCT, cu o proporție mare de opacități cu aspect de sticlă mată, inclusiv prezența reticulațiilor și a bronșiectaziei de tracțiune, deși modelul UIP poate fi observat la o proporție mică de pacienți.14,15
UIP este cel mai frecvent model HRCT în PID-AR, care se caracterizează prin reticulații și bronșiectazii de tracțiune.16
Explorați rolul HRCT în screening-ul și diagnosticarea PID-BTC

Screening pentru PID în BTC
Diagnosticul PID-BTC

Cazuri de pacienți PID-BTC pentru screening și diagnostic
Note
-
CT, tomografie computerizată; BTC, boala țesutului conjunctiv; PID-BTC, pneumopatie interstițială difuză asociată cu boala țesutului conjunctiv: PH, pneumonită de hipersensibilitate: HRCT, tomografie computerizată de înaltă rezoluție: ILA. anomalii pulmonare interstițiale: PID, pneumopatie interstițială difuză; LIP, pneumopatie interstițială limfoidă; PID-BMTC, pneumopatie interstițială difuză asociată cu boala țesutului conjunctiv mixt; NSIP, pneumopatie interstițială nespecifică; PFR, probe funcționale respiratorii; PID-AR, pneumopatie interstițială difuză asociată artritei reumatoide; ScS, scleroza sistemică; PID-ScS, pneumopatie interstițială difuză asociată sclerozei sistemice; UIP, pneumopatie interstițială obișnuită.
- Geerts S, Wuyts W, de Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Dif. 2017;34:326–335.
- Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
- Wells AU, Brown KK, Flaherty KR, et al. What’s in a name? That which we call IPF, by any other name would act the same. Eur Respir J. 2018;51(5):1800692.
- Gulati M. Diagnostic assessment of patients with interstitial lung disease. Prim Care Respir J. 2011;20:120–127.
- Greiffo FR, Eickelberg O, Fernandez IE. Systems medicine advances in interstitial lung disease. Eur Respir Rev. 2017;26:170021.
- Fischer A, Strek ME, Cotton V, et al. Proceedings of the American College of Rheumatology/Association of Physicians of Great Britain and Ireland Connective Tissue Disease–Associated Interstitial Lung Disease Summit: a multidisciplinary approach to address challenges and opportunities. Arthritis Rheumatol. 2019;71(2):182–195.
- De Lorenzis E, Bosello SL, Varone F, et al. Multidisciplinary evaluation of interstitial lung diseases: new opportunities linked to rheumatologist involvement. Diagnostics (Basel). 2020;10(9):664.
- Chung J, Goldin J. Interpretation of HRCT scans in the diagnosis of IPF: improving communication between pulmonologists and radiologists. Lung. 2018;196(5):561–567.
- Sverzellati N, Odone A, Silva M, et al. Structured reporting for fibrosing lung disease: a model shared by radiologist and pulmonologist. Radiol Med. 2018;123(4):245–253.
- Irion KL, Souza Jr AS, Marchiori E, da Silveira Dalla-Bona JP, Hochhegger B. Assessment of pulmonologists’ receptivity to a structured radiology report for interstitial lung disease. J Bras Pneumol. 2020;46(5):e20200164.
- Berkowitz EA, Bernheim A, Little BP. Introducing ILD-RADS: a pilot study of an interstitial lung disease standardized reporting template. J Am Coll Radiol. 2019;16(9 Pt A):1169–1172.
- Esposito AJ, Chu SG, Madan R, et al. Thoracic manifestations of rheumatoid arthritis. Clin Chest Med. 2019;40(3):545–560.
- Denton CP, Wells AU, Coghlan JG. Major lung complications of systemic sclerosis. Nat Rev Rheumatol. 2018;14:511–527.
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Perelas A, Silver RM, Arrossi AV, et al. Systemic sclerosis-associated interstitial lung disease. Lancet Respir Med. 2020;8(3):304–320.
- Iqbal K, Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
- Dawson JK, Fewins HE, Desmond J, et al. Predictors of progression of HRCT diagnosed fibrosing alveolitis in patients with rheumatoid arthritis. Ann Rheum Dis. 2002;61:517–521.
- Kawano-Dourado L, Doyle TJ, Bonfiglioli K, et al. Baseline characteristics and progression of a spectrum of interstitial lung abnormalities and disease in rheumatoid arthritis. Chest. 2020:S0012-3692(20)31412-4.
doi:10.1016/j.chest.2020.04.061. - Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
- Yamakawa H, Sato S, Tsumiyama E, et al. Predictive factors of mortality in rheumatoid arthritis-associated interstitial lung disease analysed by modified HRCT classification of idiopathic pulmonary fibrosis according to the 2018 ATS/ERS/JRS/ALAT criteria. J Thorac Dis. 2019;11(12):5247–5257.
- Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200:1258–1266.