Impactul PID-ScS
Pneumopatia interstițială difuză (PID) este o cauză importantă de mortalitate la pacienții cu scleroză sistemică (ScS) și poate avea un impact negativ asupra calității vieții1-6

PID ESTE CAUZA PRINCIPALĂ DE DECES ÎN ScS1
Fibroza pulmonară este principala cauză de mortalitate în ScS, reprezentând aproximativ 35% din decesele legate de ScS1,2
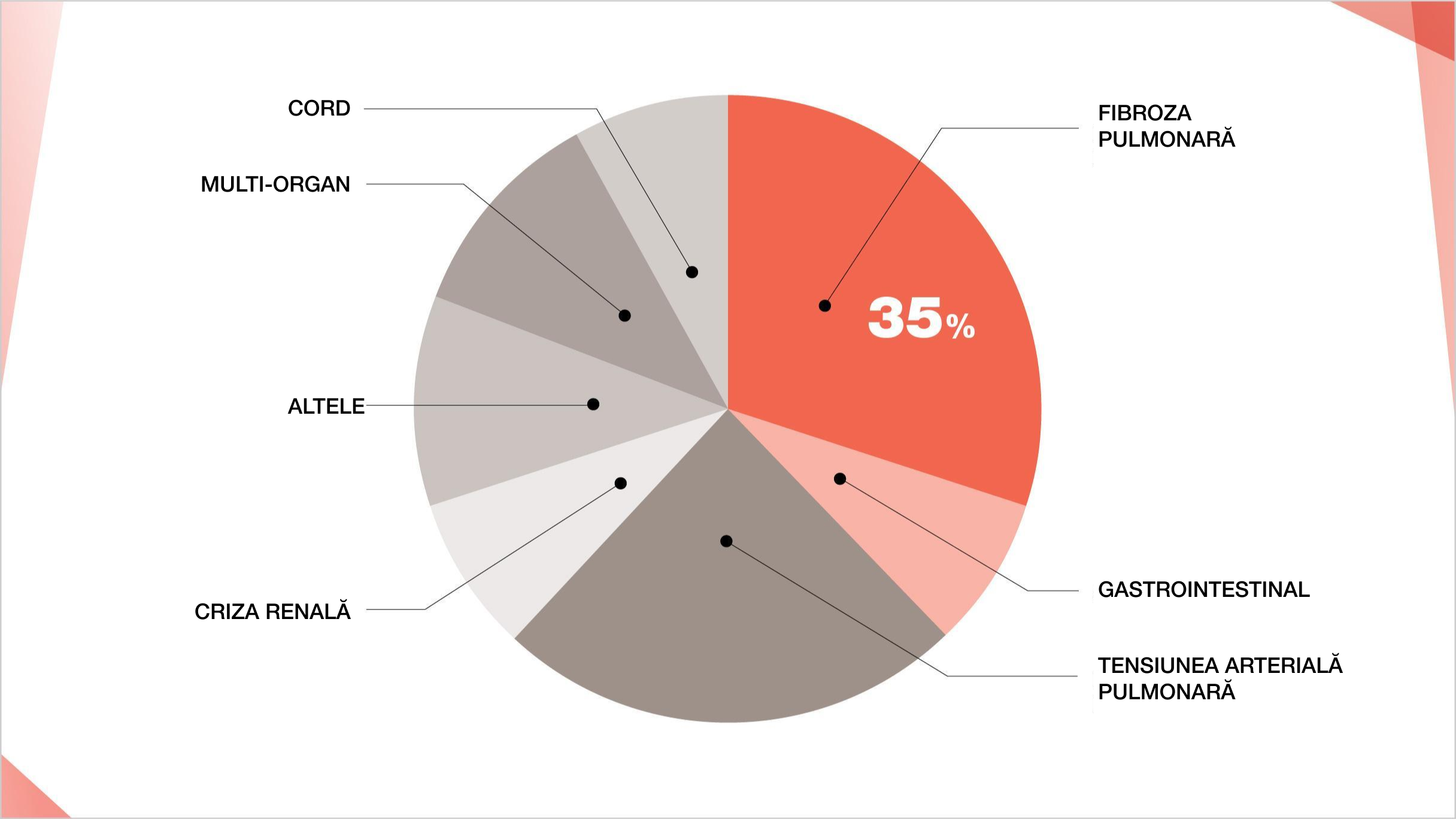
Cauzele deceselor legate de ScS (1997–2001).
Adaptat după: Steen VD and Mediger TA Ann Rheum Dis. 2007;66;944 and Tyndall AJ, et al. Ann Rheum Dis. 2010;69(10):1809-1815.
Rata de supraviețuire la 1, 5 și 10 ani pentru pacienții cu PID-ScS față de pacienții cu ScS fără PID7
Într-o cohortă canadiană de pacienți cu PID-ScS, ratele de supraviețuire la 5 și 10 ani au fost de 44,4% și, respectiv, de 22%7
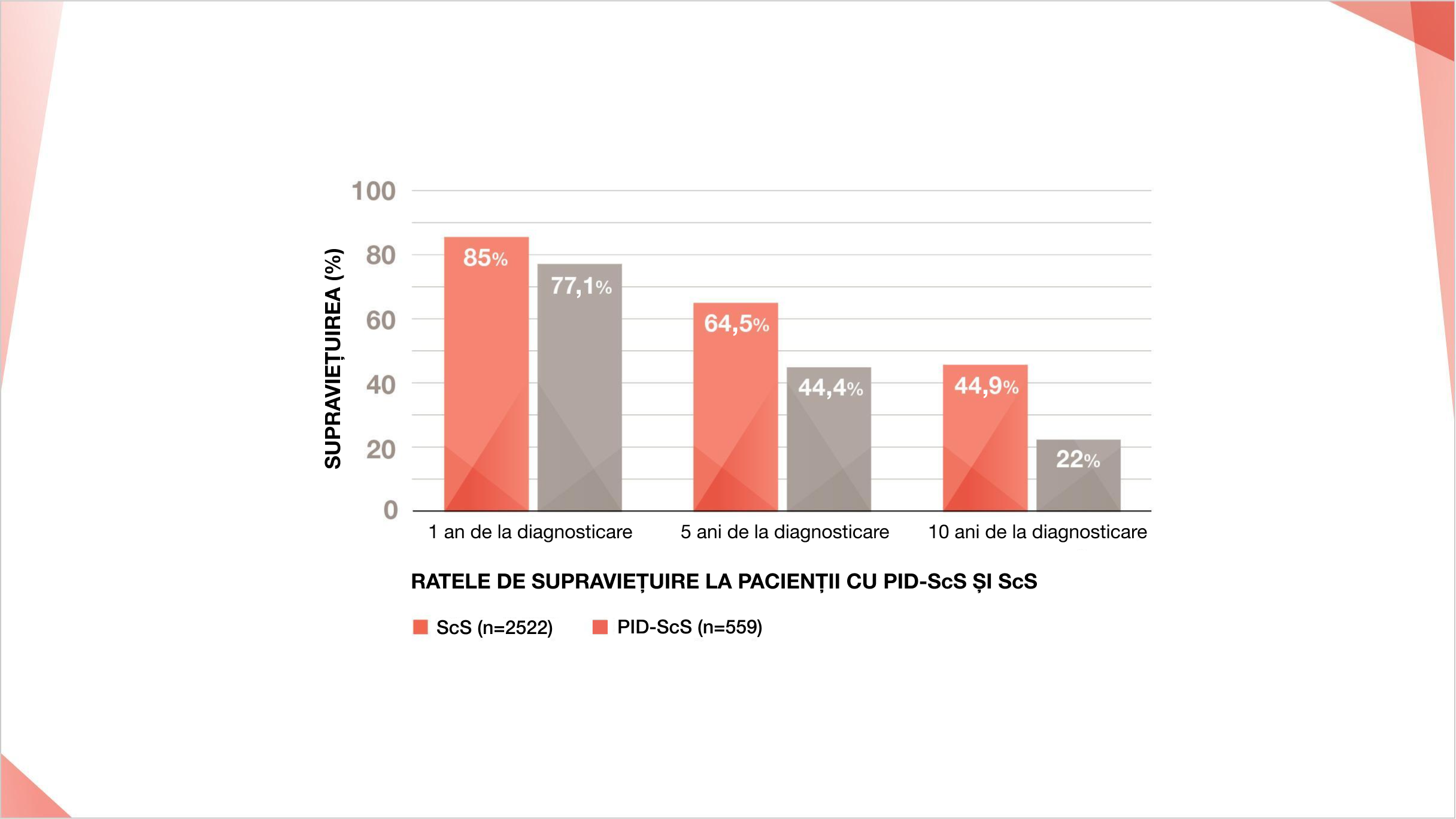
Adaptat după: Pope JE, et al. Poster presented at the 6th Systemic Sclerosis World E-Congress 2020.
FIBROZA PULMONARĂ LA MOMENTUL INIȚIAL ESTE ASOCIATĂ CU MORTALITATE CRESCUTĂ COMPARATIV CU PACIENȚII CU PID-ScS FĂRĂ FIBROZĂ PULMONARĂ8
În cohorta norvegiană PID-ScS, fibroza per se conferă un risc crescut de mortalitate în PID-ScS8
S-a demonstrat că orice extindere a fibrozei pulmonare la momentul inițial prezintă un risc crescut de mortalitate la pacienții cu PID-ScS în comparație cu populația generală.8 Această rată standard a mortalității crește odată cu creșterea gradului de fibroză.8
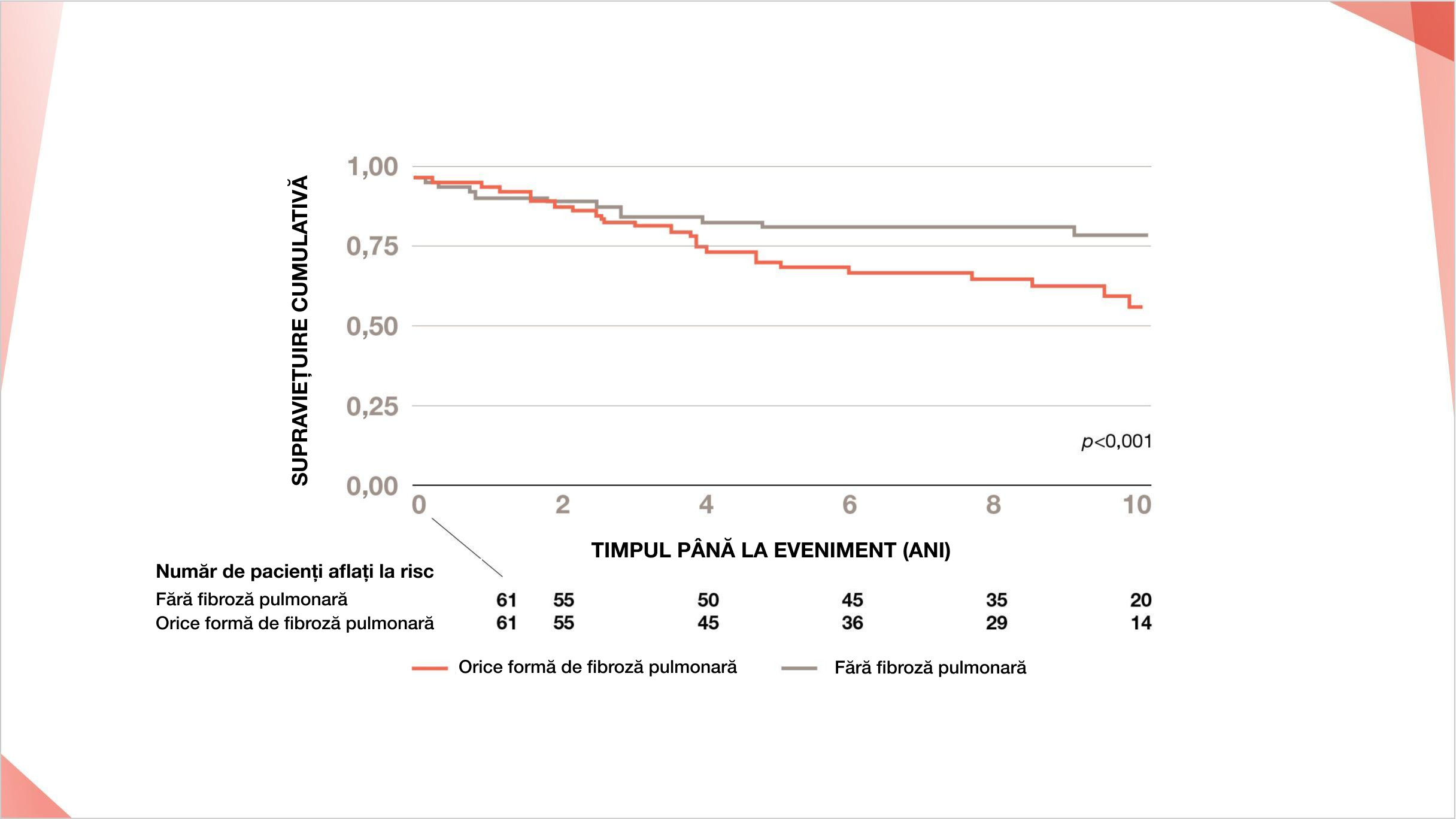
Rata de supraviețuire cumulată la 1,5 și 10 ani după diagnosticul PID prezentat de curbele Kaplan-Meier într-o cohortă norvegiană. Timpul până la deces la pacienții cu CVF% normală (CVF 80–100%) stratificat prin prezența sau absența fibrozei pulmonare prin HRCT p<0,001.
Retipărit cu permisiunea Annals of the American Thoracic Society, 200(10), Hoffmann-Vold et al, Tracking Impact of Interstitial Lung Disease in Systemic Sclerosis in a Complete Nationwide Cohort, 1258-1266, ©2022
Într-o cohortă norvegiană de pacienți PID-ScS, gradul >10% a fibrozei la HRCT a fost asociat cu rate standard de mortalitate semnificativ mai mari8
Fibroza pulmonară per se conferă risc crescut de mortalitate în ScS, arătat pentru prima dată într-un studiu de cohortă norvegian de pacienți cu ScS (N=630).8 SMR a corelat cu gradul de fibroză, cel mai mare SMR observat la pacienții cu >10% fibroză (SMR a crescut de la 2,2 fără fibroză la 8,0 cu >25% fibroză).8
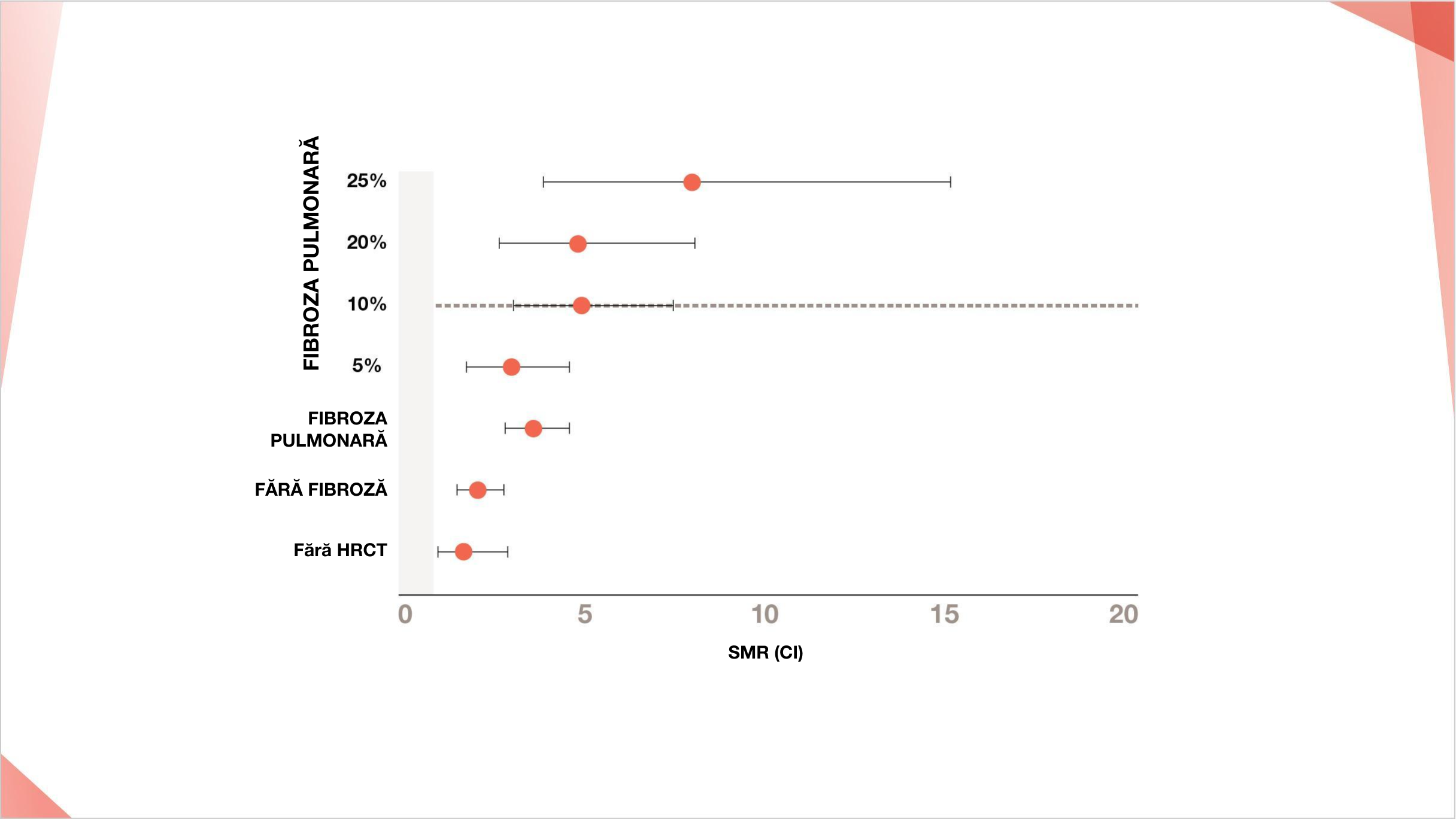
Adaptat după: Hoffmann Vold A-M, et al. Am J Respir Crit Care Med. 2019; 200:1258-1266.
Boala pulmonară extinsă, clasificată ca extindere a bolii >20% pe HRCT, este asociată cu o mortalitate mai mare (HR 2,48, 95% CI 1,57–3,92, p<0,0005)9
Un prag de extinderea bolii pe HRCT de 20% este asociat cu o creștere substanțială a mortalității9
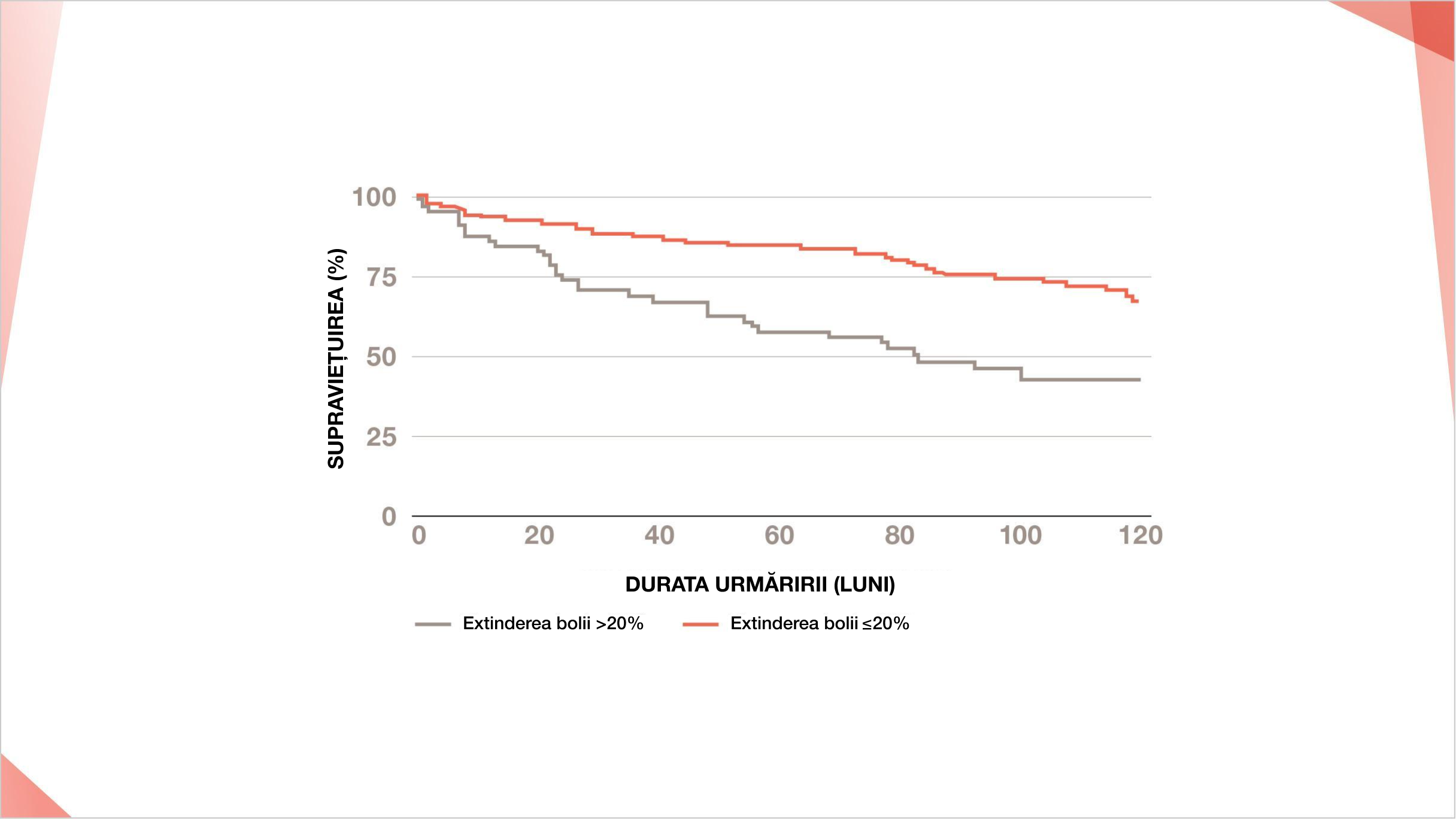
Curba de supraviețuire Kaplan-Meier a pacienților cu PID-ScS cu extindere a bolii HRCT > 20% (n=64) și a pacienților cu HRCT și a pacienților cu extinderea bolii HRCT ≤20% (n=151).
Reprint după: Annals of the American Thoracic Society, 177(137), Cappelli et al, Interstitial lung disease in systemic sclerosis: where do we stand?, 411–419, ©2022.
CHIAR DECLINUL ANUAL REDUS DE CVF <5% DIN VALOAREA PREZISĂ POATE CONDUCE LA MORTALITATE ÎN DECURS DE 4-8 ANI LA PACIENȚII CU PID-ScS12
Unele studii au sugerat că declinul CVF este cel mai rapid la începutul evoluției ScS și se poate stabiliza după primii 4 ani.12 Cu toate acestea, dovezile recente indică faptul că declinul CVF în PID-ScS nu se stabilește după o perioadă inițială de progresie, ci în schimb progresează la rate distincte care se corelează cu intervale de timp diferite de mortalitate.12
Progresia CVF % din valoarea prezisă la pacienții cu PID-ScS clasificați pe grupuri de risc12
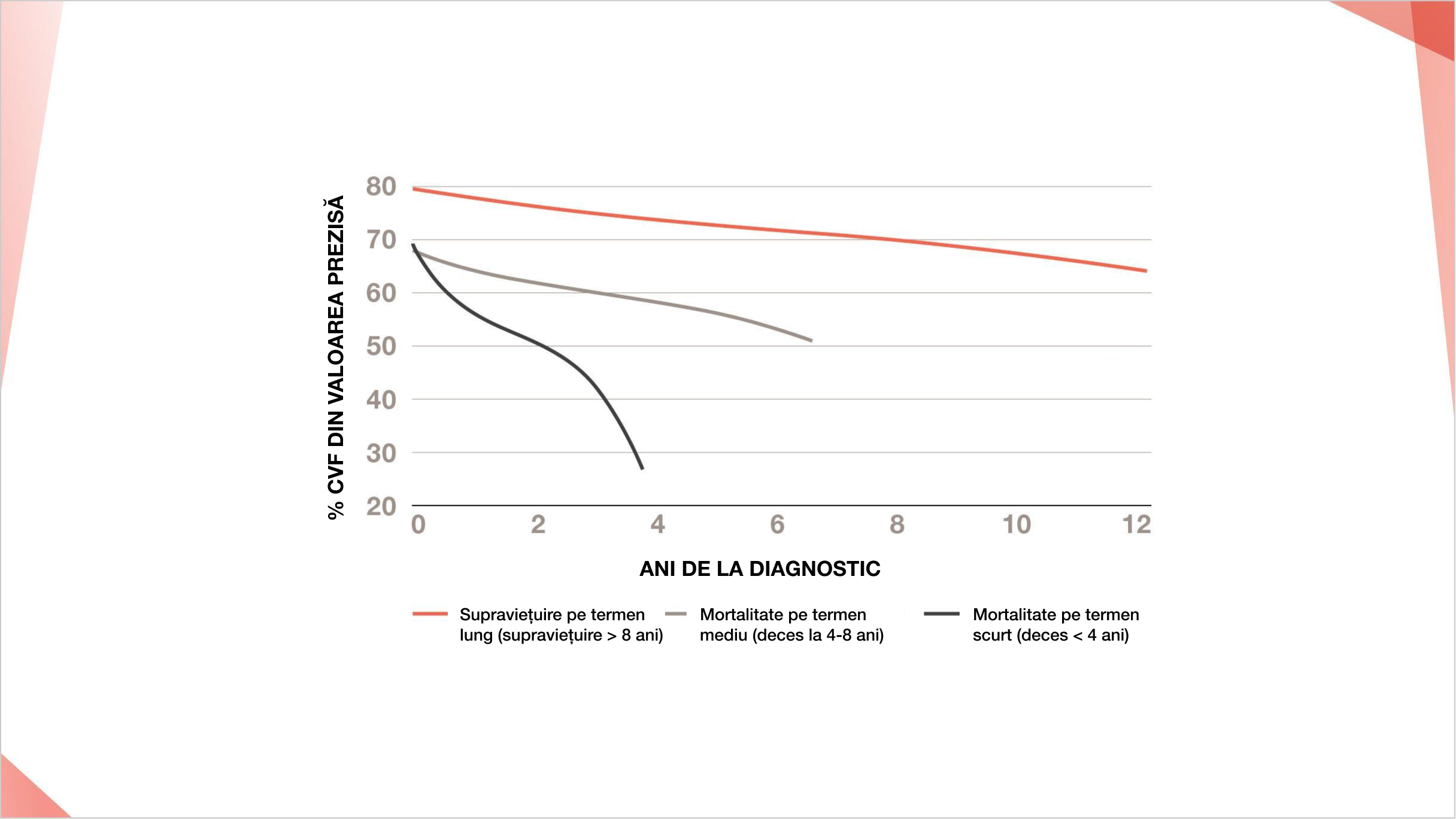
Progresia CVF (% prezis) la 171 de pacienți cu PID-ScS clasificați pe grupuri de prognostic.
Retipărit cu permisiunea Annals of the American Thoracic Society, 15(12), Guler et al, Does Systemic Sclerosis-associated Interstitial Lung Disease Burn Out?, 1427–1433, ©2022.
FVC scăzut (% din valoarea prezisă) și declinul CVF sunt predictori ai mortalității în PID-ScS14
Într-un studiu pe termen lung din Marea Britanie, scăderile relative anuale ale CVF de ≥10% din valoarea prezisă pe parcursul a 12 luni au fost puternic asociate cu mortalitatea pacienților cu PID-ScS peste 15 ani (HR 1,84, 95% CI 1,14–2,97, p=0,01)14
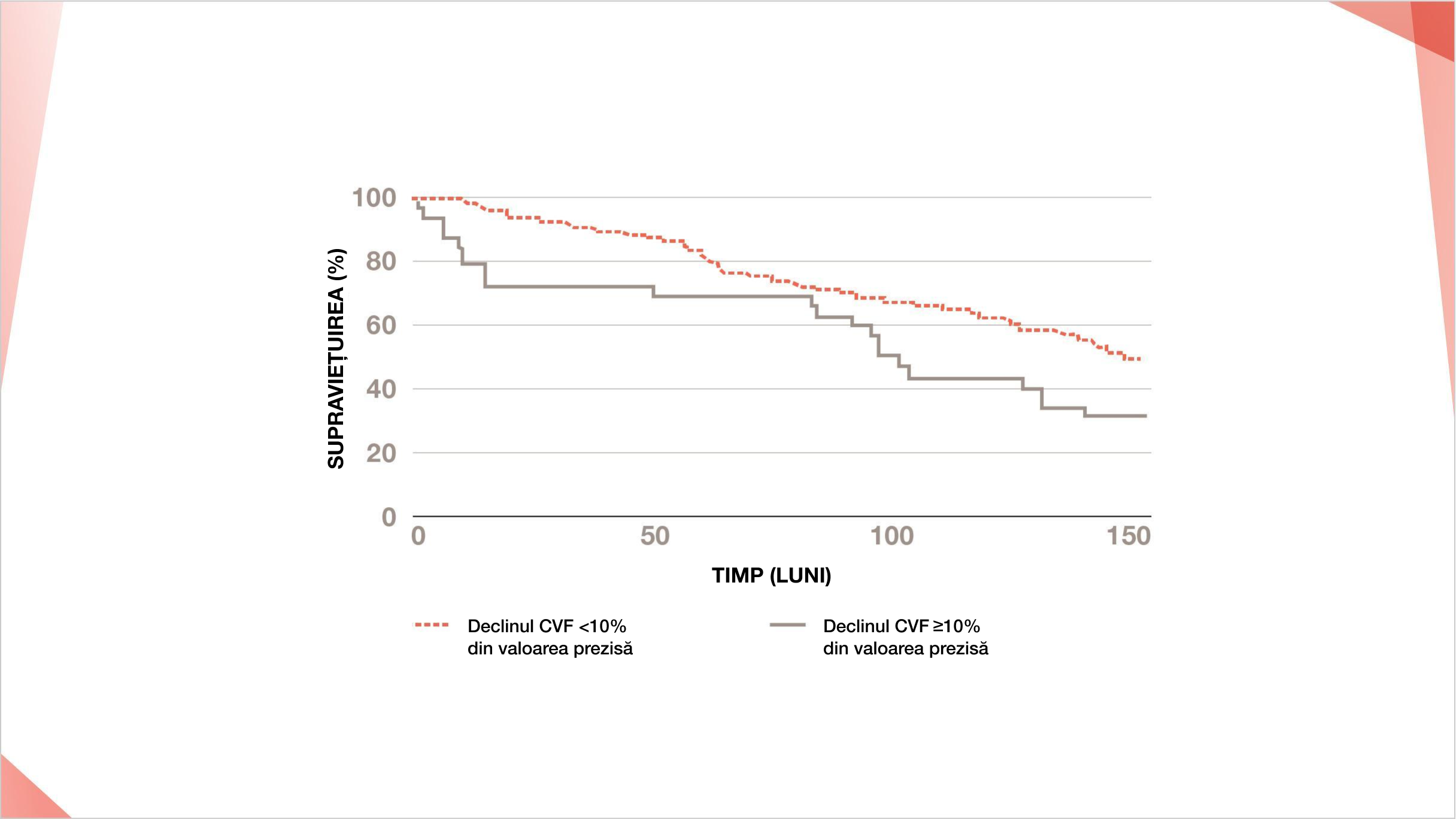
Curba de supraviețuire Kaplan-Meier pentru o cohortă de 162 de pacienți cu PID-ScS în funcție de declinul CVF <10% și declinul CVF ≥10%.
Tendințele funcției pulmonare pe termen scurt sunt predictive ale mortalității în pneumopatia interstițială difuză asociată cu scleroza sistemică. Goh et al, ©2022. Reprodus cu permisiunea John Wiley & Sons Inc.
CVF <80% prezisă la momentul inițial este un predictor al mortalității în PID-ScS1
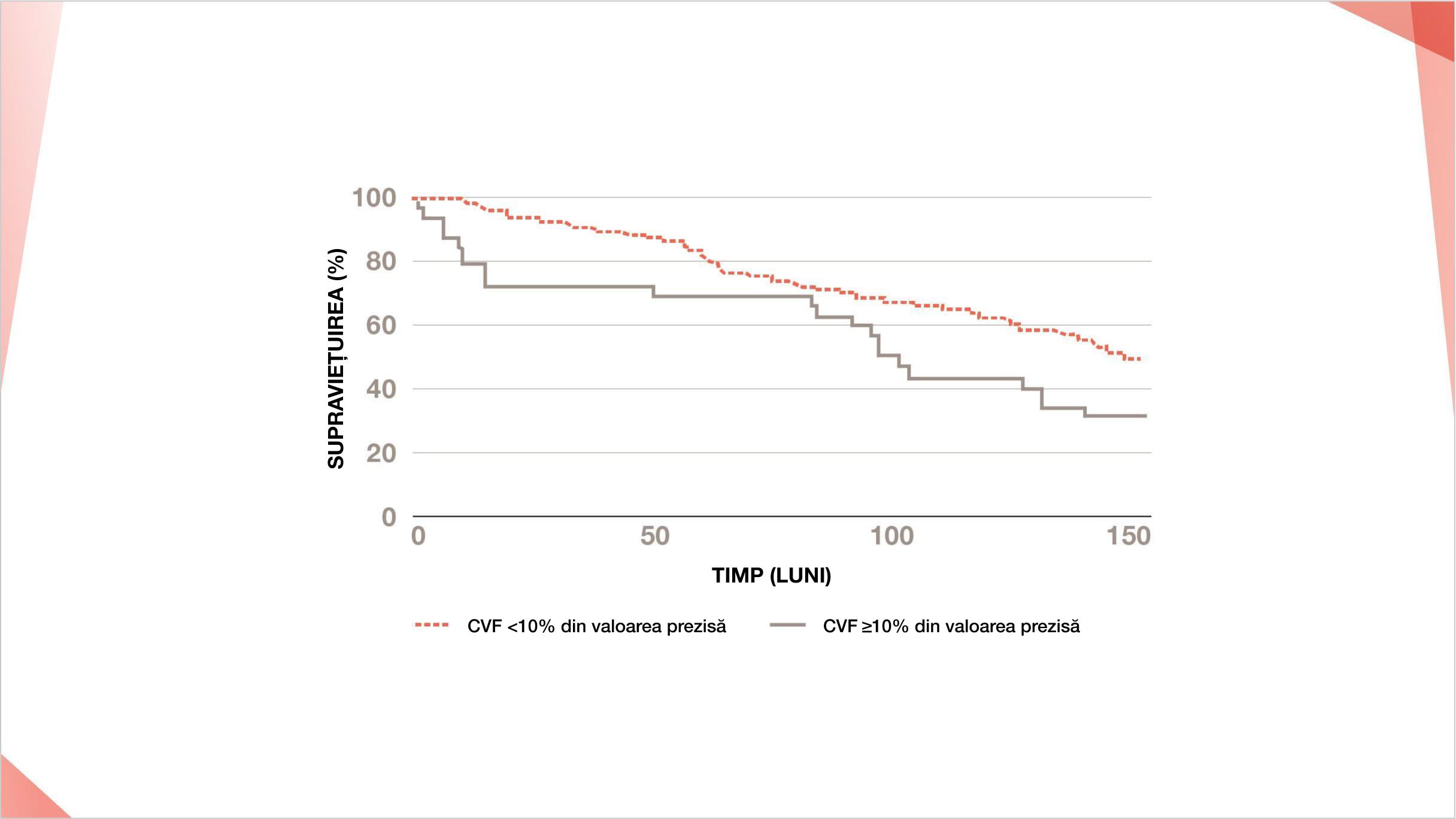
Grafice Kaplan-Meier pentru supraviețuirea SSc pe baza datelor de urmărire a 2940 de pacienți dintre care 294 au murit. Mortalitatea ScS este reprezentată grafic în funcție de prezența sau absența restricțiilor pulmonare. Reprodus după Annals of the Rheumatic Diseases, Tyndall et al, 69(10), 1809-1815, ©2022, cu permisiunea BMJ Publishing Group Ltd.
VÂRSTA MEDIE LA PREZENTARE, SEXUL MASCULIN, GRADUL DE EXTENSIE A FIBROZEI PULMONARE, VALORIILE INIȚIALE SCĂZUTE ȘI DECLINUL CVF ȘI DLCO SUNT TOȚI FACTORI DE RISC PENTRU MORTALITATE ÎN PID-SCS1,8,14-16
Factori de risc pentru mortalitate în PID-ScS | |
|---|---|
Vârsta | Vârsta înaintată la prezentare15,17 |
Sex | Bărbat15,17 |
CVF | <80%1 |
DLCO | Valoarea inițială a DLCO % din valoarea prezisă <40%18 DLCO % din valoarea prezisă <40%1 Declinul DLCO procent din valoarea prezisă <15%19 |
Extinderea gradului de fibroză la HRCT | Extinderea gradului de fibroză >10% pe HRCT8 |
Fumatul | Fumatul activ și istoricul de fumat12,15 |

S-a demonstrat că vârsta înaintată la diagnosticare afectează negativ supraviețuirea (HR 1,04, 95% CI 1,03–1,05)17

SIMPTOMELE PID POT AVEA UN IMPACT NEGATIV ASUPRA CALITĂȚII VIEȚII LA PACIENȚII CU PID-ScS3-6
Simptomele de tuse și dispnee pot compromite calitatea vieții pacienților și pot afecta negativ capacitatea pacienților de a efectua activități esențiale pentru viața lor de zi cu zi21
Simptomele PID-ScS pot contribui semnificativ la reducerea calității vieții21,22

Impactul social

Afectează somnul și sănătatea

Impactul asupra bunăstării și productivității

Impactul emoțional
Pacienții cu PID-ScS se confruntă cu oboseală, depresie, precum și efecte semnificative asupra bunăstării și productivității lor.22
Simptomele PID pot avea efecte negative asupra calității vieții pacienților22
Impactul asupra bunăstării | Pierderea productivității | Nevoia de sprijin |
|---|---|---|
| 22,6% dintre pacienții cu PID-ScS au depresie | 40,4% dintre pacienții cu PID-ScS se pensionează anticipat | 2,0% dintre pacienții cu PID-ScS au nevoie de sprijin plătit pentru îngrijitor (de exemplu, asistentă medicală) |
| 40,3% dintre pacienții cu ScS prezintă oboseală | 11,9 ani între pensionarea efectivă și vârsta legală pentru aceasta | 37,7% dintre pacienții cu PID-ScS au nevoie de sprijin de la un îngrijitor neprofesionist (de exemplu, un membru al familiei) |
| 44,7% din PID-ScS extinse au dizabilitate permanentă (8,5% din PID-ScS limitată) | 22,3 ore de muncă de îngrijire neremunerată dedicate unui pacient PID-ScS, săptămânal | |
| 29,3% dintre PID-ScS extinse și-au pierdut locul de muncă din cauza bolii lor (5% din PID-ScS limitată) | 100% dintre participanți sunt de acord că îngrijitorii neplătiți au afectat calitatea vieții |
Adaptat după: Wuyts W, et al. 2020. Poster presented at the 6th Systemic Sclerosis World E-Congress 2020.
EXACERBAREA ACUTĂ A PID ESTE UN PREDICTOR SEMNIFICATIV AL REZULTATELOR NEGATIVE ȘI AL SUPRAVIEȚUIERII SCURTE ÎN PID-ScS23

Într-o cohortă japoneză, 4 din 35 de pacienți cu PID-ScS au dezvoltat exacerbare acută a PID în timpul perioadei de urmărire și toți 4 au decedat23
Curbele de supraviețuire pentru exacerbarea acută a PID în PID-ScS într-un studiu japonez23
EA în PID a fost un predictor semnificativ al rezultatului slab în PID-ScS (p=0,0013).
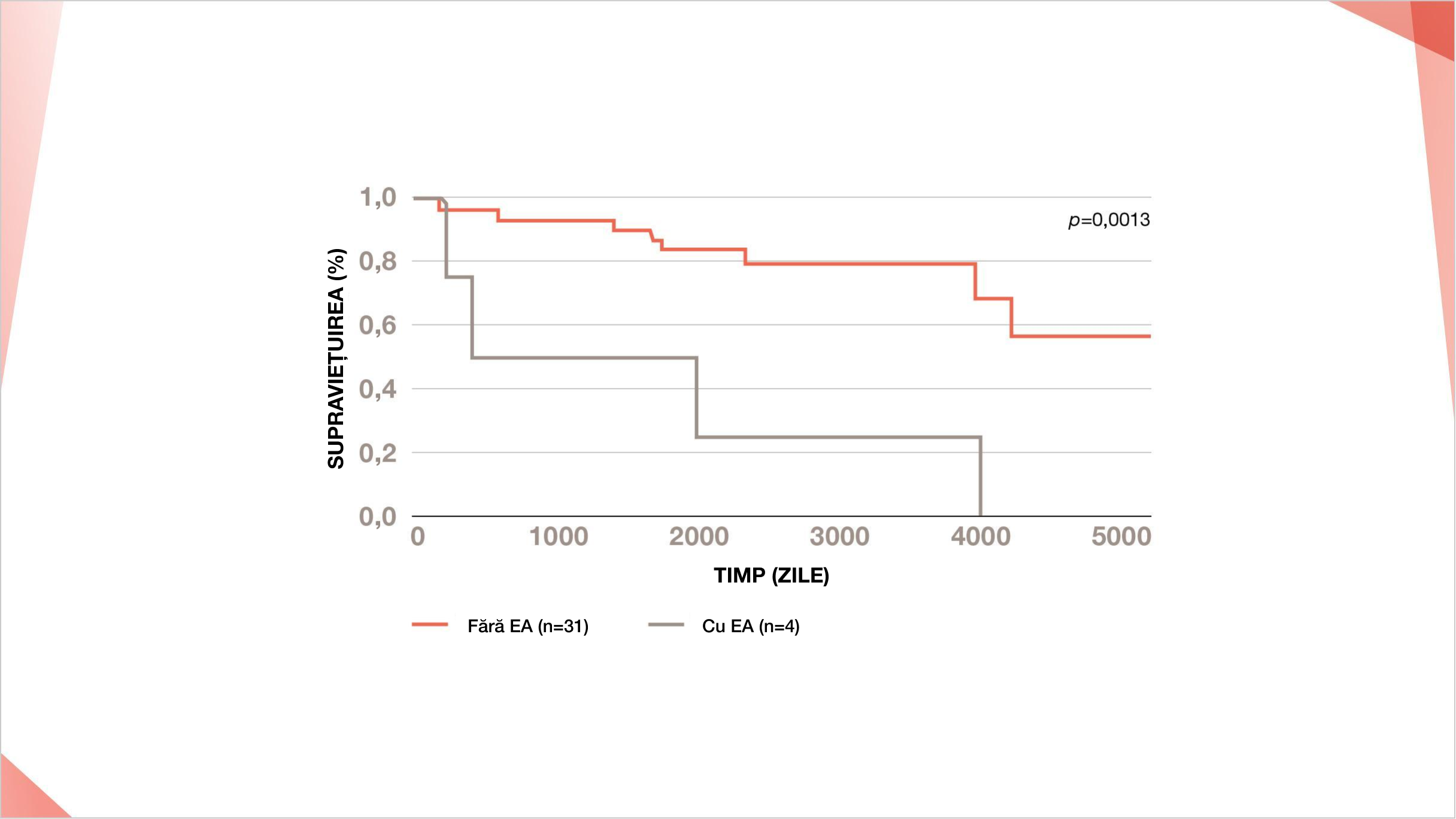
Retipărit după Respiratory Investigation, 54(6), Okamoto et al, A retrospective cohort study of outcome in systemic sclerosis-associated interstitial lung disease, 445-453, ©2022, cu permisiunea Elsevier.
Cum puteți identifica, trata și gestiona PID la pacienții cu ScS?

Screening pentru PID în ScS
Diagnosticul PID-ScS

Managementul PID-ScS
Note
-
EA, exacerbare acută; CI, interval de încredere; DLCO, factorul de transfer gazos pentru monoxid de carbon; DM, dermatomiozită; CVF, capacitate vitală forțată; HR, hazard ratio; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză; KL-6, Krebs von den Lungen-6; PM, polimiozită; SMR, rata standard de mortalitate; ScS, scleroză sistemică; PID-ScS, pneumopatie interstițială difuză asociată sclerozei sistemice; UIP, pneumoparie interstițială uzuală.
- Tyndall AJ, Bannert B, Vonk M, et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis. 2010;69;1809–1815.
- Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972-2002. Ann Rheum D. 2007;66;940–944.
- Cheng JZ, Wilcox PG, Glaspole I, et al. Cough is less common and less severe in systemic sclerosis-associated interstitial lung disease compared to other fibrotic interstitial lung diseases: Cough severity in fibrotic ILD. Respirology. 2017;22:1592–1597.
- Tashkin D, Volkmann E, Tseng C et al. Improved cough and cough-specific quality of life in patients treated for scleroderma-related interstitial lung disease results of scleroderma lung study II. Chest. 2017;151(4):813–820.
- Baron M, Sutton E, Hudson M, et al. The relationship of dyspnoea to function and quality of life in systemic sclerosis. Ann Rheum Dis. 2008;67; 644–650.
- Theodore AC, Tseng CH, Li N, E et al. Correlation of cough with disease activity and treatment with cyclophosphamide in scleroderma interstitial lung disease: findings from the scleroderma lung study. Chest. 2012;142;614–21.
- Pope JE, Quansah K, Kolb M, et al. Systemic sclerosis (SSc) with interstitial lung disease (SSc-ILD) in Canada’s largest province: an estimate of the prevalence and survival of SSc and SSc-ILD in Ontario over 10 years. Poster presented at the 6th Systemic Scelerosis World E-Congress 2020.
- Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200;1258–1266.
- Goh NS, Desai SR., Veeraraghavan S, et al. Interstitial lung disease in systemic sclerosis: a simple staging system. Am J Respir Crit Care Med. 2008;177:1248–1254.
- Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. Lancet Rheum. 2020;2 e71–e83.
- Asano Y, Jinnin M, Kawaguchi Y, et al. Diagnostic criteria, severity classification and guidelines of systemic sclerosis: Guideline of SSc. J Dermatol. 2018;45;633–691.
- Guler, S.A., Winstone, T.A., Murphy, D., et al. Does systemic sclerosis–associated interstitial lung disease burn out? Specific phenotypes of disease progression. Annals ATS. 2018;15;1427–1433.
- Hoffmann-Vold AM, Allanore Y, Alves M, et al. Progressive interstitial lung disease in patients with systemic sclerosis-associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020. Epub ahead of print: doi:10.1136/annrheumdis-2020-217455.
- Goh NS, Hoyles RK, Denton CP, et al. Short-term pulmonary function trends are predictive of mortality in interstitial lung disease associated with systemic sclerosis. Arthritis Rheumatol. 2017;69;1670–1678.
- Perelas A, Silver RM, Arrossi AV, et al. Systemic sclerosis-associated interstitial lung disease. Lancet Respir Med. 2020;8;304–320.
- Volkmann ER, Tashkin DP, Sim M. et al. Short-term progression of interstitial lung disease in systemic sclerosis predicts long-term survival in two independent clinical trial cohorts. Ann Rheum Dis. 2019;78(1);122–130.
- Mayes M, Lacey J, Beebe-Dimmer J et al. Prevalence, incidence, survival, and disease characteristics of systemic sclerosis in a large US population. Arthritis Rheum. 2003;48:2246–2255.
- Morisset J, Vittinghoff E, Elicker BM, et al. Mortality risk prediction in scleroderma-related interstitial lung disease: the SADL model. Chest. 2017;152(5):999–1007.
- Suliman YA, Dobrota R, Huscher D, et al. Brief Report: Pulmonary Function Tests: High Rate of False-Negative Results in the Early Detection and Screening of Scleroderma-Related Interstitial Lung Disease. Arthritis Rheumatol. 2015;67;3256–3261.
- Volkmann ER, Tashkin DP. Treatment of systemic sclerosis–related interstitial lung disease: a review of existing and emerging therapies. Annals ATS. 2016;13;2045–2056.
- Distler O, Volkmann ER, Hoffmann-Vold AM, et al. Current and future perspectives on management of systemic sclerosis-associated interstitial lung disease. Expert Rev Clin Immunol. 2019;15;1009–1017.
- Wuyts W, Romild Davidson J, Kilpelainen M et al. Management and burden of disease of SSc-ILD in eight European countries: Results of the BUILDup project. Poster presented at the 6th Systemic Sclerosis World E-Congress 2020.
- Okamoto M, Fujimoto K, Sadohara J, et al. A retrospective cohort study of outcome in systemic sclerosis-associated interstitial lung disease. Respiratory Investigation. 2016;54;445–453.
- Denton C, Hughes M, Gak N et al. BSR and BHPR guideline for the treatment of systemic sclerosis. Rheumatology. 2016;55;1906–1910.
- Roofeh D, Jaafar S, Vummidi D, et al. Management of systemic sclerosis-associated interstitial lung disease. Curr Opin Rheumatol. 2019;31;241–249.
- Fischer A, Patel NM, Volkmann ER. Interstitial lung disease in systemic sclerosis: focus on early detection and intervention. OARRR. 2019;11;283–307.
