Impactul PID-BTC
Pneumopatia interstițială difuză (PID) este un factor cheie al mortalității precoce în bolile țesutului conjunctiv (BTC)1–6

PID-BTC FIBROZANTE SUNT CARACTERIZATE DE FIBROZĂ PULMONARĂ CARE POARTĂ AMENINȚAREA MORTALITĂȚII PRECOCE1–5
Rata mortalității pe 5 ani a PID-BTC7–13
Estimările ratei mortalității pentru diferite PID-BTC variază între diferitele studii. Ratele de mortalitate pe 5 ani prezentate mai jos se bazează pe o serie de estimări din diferite studii7–13
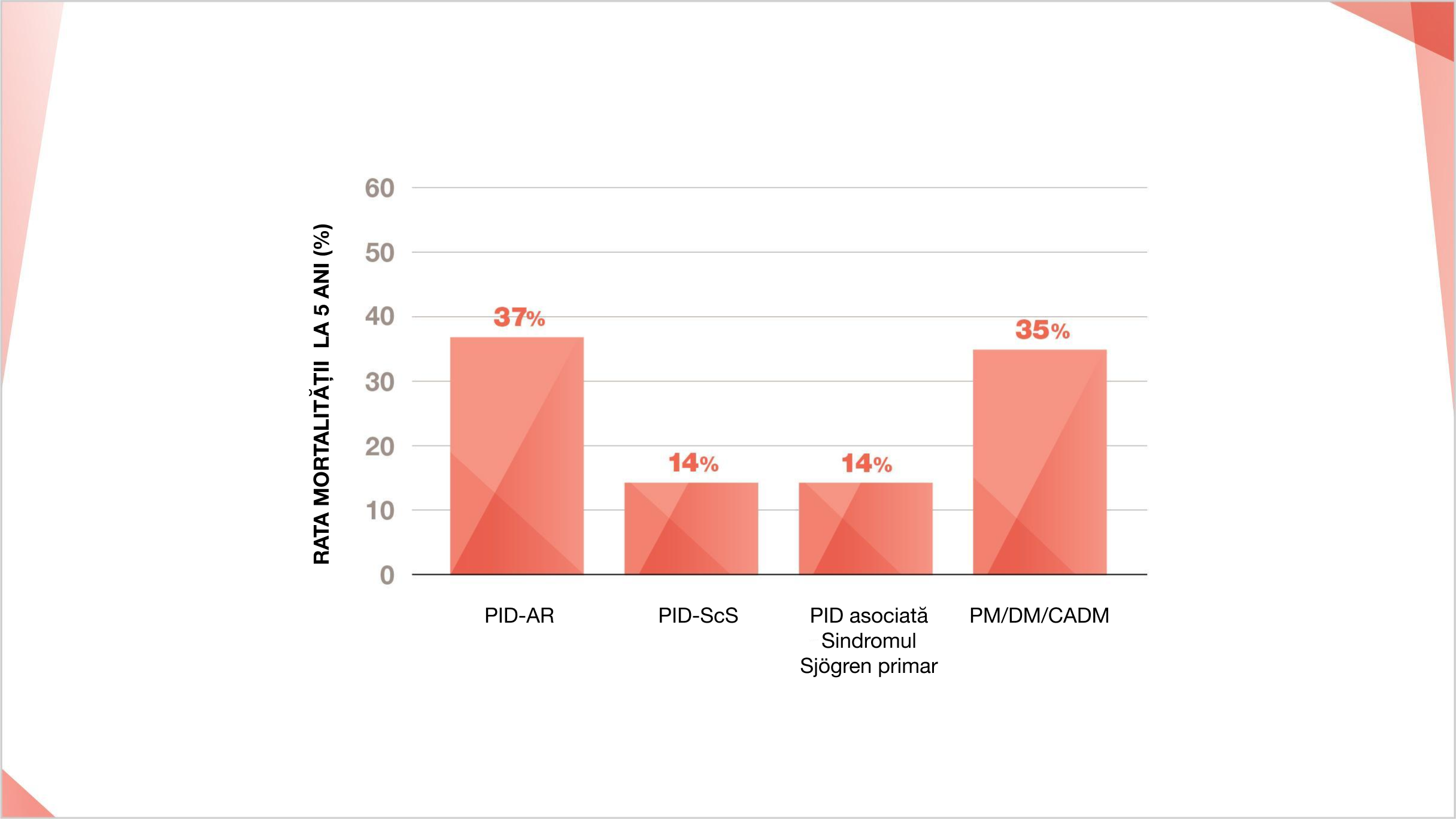
Ratele de mortalitate pe 5 ani sunt obținute ca valori medii din intervalele pentru PID-BTC; Rata mortalității la 5 ani astfel: PID-AR Rata mortalității la 5 ani 35%-39%7,8 ; PID-ScS rata mortalității la 5 ani 10%-18%9 ; PID asociată Sindromul Sjorgren primar
Rata mortalității la 5 ani 12-16%10–12 polimiozită PM/DM/CADM/ /dermatomiozită/ dermatomiozită clinică amiopatică) 35% rata mortalității la 5 ani13


PID este o cauză importantă de mortalitate în AR15,16
Aflați mai multe despre impactul mortalității în PID-AR

PID crește riscul de mortalitate în sindromul Sjögren primar10–12,17
Aflați mai multe despre impactul mortalității în PID asociată sindromului Sjögren primar
AMINTIȚI-VĂ FACTORII DE RISC ASOCIAȚI CU MORTALITATEA PRECOCE ATUNCI CÂND EVALUAȚI PACIENȚII CU PID-BTC
| Factori de risc pentru mortalitatea precoce în PID-BTC | |
|---|---|
HRCT | |
Funcția pulmonară | |
Datele demografice | |
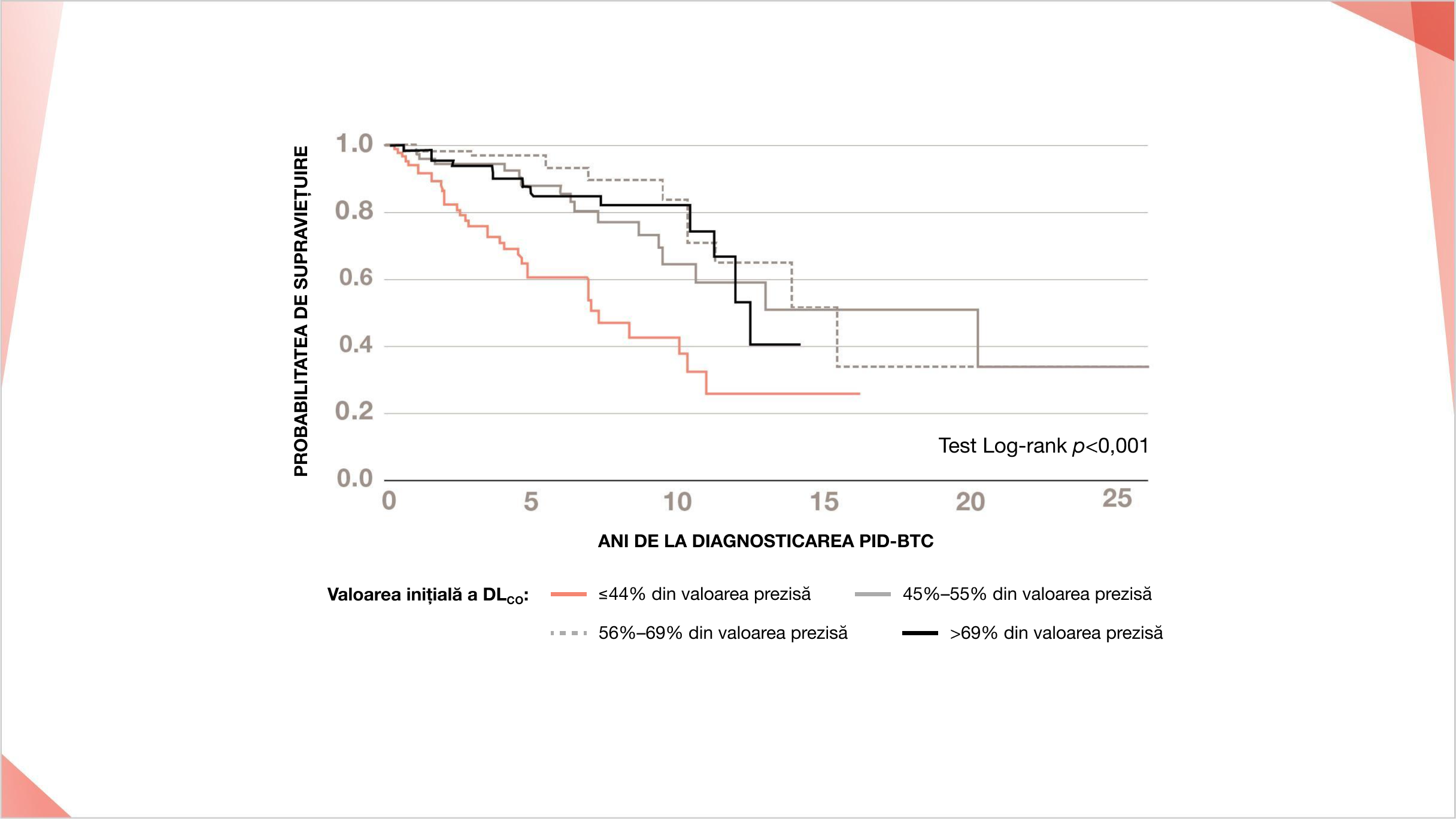
Abordările actuale ale monitorizării funcției pulmonare în PID-BTC au fost influențate de studiile FPI în care scăderea seriată a CVF și DLco a fost predictivă pentru mortalitatea precoce21
În ScS, DLco < 40% CVF<80% și un raport restrictiv VEMS/FVC sunt predictive pentru o creștere marcată a mortalității21
EXTINDEREA LEZIUNILOR CU ASPECT DE FAGURE DE MIERE PE HRCT, PRECUM ȘI DLCO SCĂZUT SUNT PUTERNIC ASOCIATE CU MORTALITATEA ÎN PID-BTC FIBROZANTE19,22
Prezența aspectului de fagure de miere pe HRCT este asociat cu o rată crescută a mortalității pe termen lung la pacienții cu PID-BTC față de absența acestui aspect (p<0,001)20
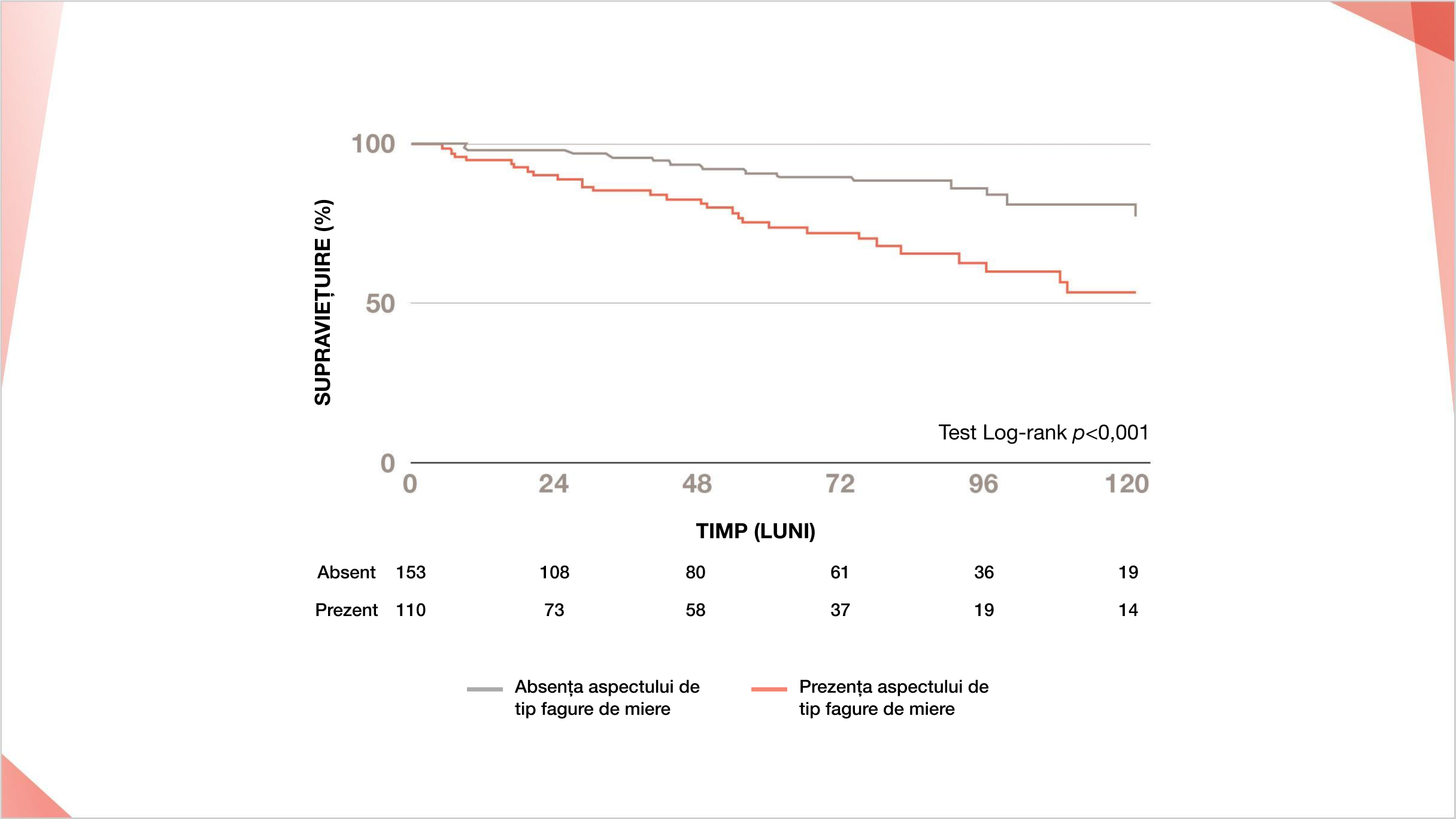
Supraviețuirea la 10 ani la pacienții cu PID-BTC cu aspect de fagure de miere prezent sau absent
Retipărit după Annals of the American Thoracic Society, 16(5), Adegunsoye et al, Computed Tomography Henycombing Identifies a Progressive Fibrotic Phenotype with increased Morality across Diverse Interstitial Lunf Diseases, 580-588, ©2022.
Aflați cum să investigați caracteristicile imagistice ale PID-BTC cu HRCT
DLco inițial mai scăzut și scăderea DLco sunt asociate cu o mortalitate crescută în PID-BTC fibrozante18,19
Exacerbarea acută a PID se caracterizează prin deteriorare respiratorie rapidă cu hipoxemie severă22,26,27,29,30
Aflați despre exacerbarea acută a PID în PID-ScS

Exacerbarea acută a PID poate apărea la pacienţii cu PID-BTC în orice moment pe parcursul evoluției bolii22,26,27,29,30
Aflați despre exacerbarea acută a PID în PID-AR

Mortalitatea intraspitalicească după exacerbare la pacienții cu PID-BTC este raportată a varia de la 50%-100%23
Aflați despre exacerbarea acută a PID în sindromul Sjögren primar

Tuse

Dispnee

Fatigabilitate
S-a descoperit că tusea și dispneea sunt asociate cu frustrare, rușine, furie și izolare în rândul pacienților, ceea ce duce la o pierdere a pregătirii pentru activități plăcute, cum ar fi mersul pe jos, dansul sau jocul cu copiii31
Tusea legată de PID afectează negativ activitățile fizice, participarea socială, activitățile din viața de zi cu zi și calitatea somnului31
Dispneea afectează capacitatea pacienților de a efectua activități funcționale și prioritățile de viață31
PID-BTC a fost asociat atât cu dizabilități zilnice pe termen scurt, cât și cu dificultăți pe termen lung în ceea ce privește planificarea activităților31
Pacienții cu PID-BTC trăiesc cu incertitudine și anxietate și se pot avea probleme cu identitatea de sine31
Pacienții cu PID-BTC progresivă prezintă o suferință emoțională care poate include sentimente de depresie, anxietate și de lipsa independenței34,35
Cum puteți identifica PID fibrozantă la debut în cazul pacienților dumneavoastră cu BTC?

Cazuri de pacienți PID-BTC

Monitorizarea precoce și regulată a progresiei PID în PID-BTC

Managementul PID-BTC cu fenotip fibrozant progresiv
Note
6MWD, testul de mers pe jos timp de 6 minute de mers pe jos; CADM, dermatomiozită clinică amiopatică; BTC, boli ale țesutului conjunctiv; PID-BTC, pneumopatie interstițială difuză asociată cu boli ale țesutului conjunctiv; DLco, factorul de transfer gazos pentru monoxid de carbon, DM, dermatomiozită; CVF, capacitate vitală forțată; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză, PM, polimiozită; AR artrita reumatoidă AR, pneumopatie interstițială difuză asociată cu artrita reumatoidă; ScS, scleroză sistemică; PID-ScS, pneumopatie interstițială difuză asociată sclerozei sistemice
- Fischer A and Distler J. Progressive fibrosing interstitial lung disease associated with systemic autoimmune diseases. Clin Rheumatol. 2019;38(10):2673–2681.
- Mathai SC and Danoff SK. Management of interstitial lung disease associated with connective tissue disease. BMJ. 2016;352:h6819.
- Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
- Spagnolo P, Cordier JF, Cottin V. Connective tissue diseases, multimorbidity and the ageing lung. Eur Respir J. 2016;47(5):1535–1558.
- Vacchi C, Sebastiani M, Cassone G, et al. Therapeutic options for the treatment of interstitial lung disease related to connective tissue diseases. A narrative review. J Clin Med. 2020;9(2):407. doi: 10.3390/jcm9020407.
- Maher TM, Wuyts W. Management of fibrosing interstitial lung diseases. Adv Ther. 2019;36(7):1518–1531.
- Hyldgaard C, Hilberg O, Pedersen AB, et al. A population-based cohort study of rheumatoid arthritis-associated interstitial lung disease: comorbidity and mortality. Ann Rheum Dis. 2017;76(10):1700–1706.
- Raimundo K, Solomon JJ, Olson AL, et al. Rheumatoid arthritis – interstitial lung disease in the United States: prevalence, incidence, and healthcare costs and mortality. J Rheumatol. 2019;46(4):360–369.
- Bouros D, Wells AU, Nicholson AG, et al. Histopathologic Subsets of Fibrosing Alveolitis in Patients with Systemic Sclerosis and Their Relationship to Outcome. Am J Respir Crit Care Med. 2002;165:1581–1586.
- Palm Ø, Garen T, Enger TV, et al. Clinical pulmonary involvement in primary Sjögren’s syndrome: prevalence, quality of life and mortality—a retrospective study based on registry data. Rheumatology. 2013;52:173-179.
- Ito I, Nagai S, Kitaichi M, et al. Pulmonary Manifestations of Primary Sjögren’s Syndrome: A Clinical, Radiologic, and Pathologic Study. Am J Respir Crit Care Med. 2005;171:632–638.
- Enomoto Y, Takemura T, Hagiwara E, et al. Prognostic Factors in Interstitial Lung Disease Associated with Primary Sjögren’s Syndrome: A Retrospective Analysis of 33 Pathologically–Proven Cases. PLoS One. 2013;8:e73774.
- Ji S-Y, Zeng F-Q, Guo Q, et al. Predictive factors and unfavourable prognostic factors of interstitial lung disease in patients with polymyositis or dermatomyositis: a retrospective study. Chin Med J (Engl). 2010;123(5):517–522.
- Tyndall AJ, et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis. 2010;69(10):1809-1815. doi:10.1136/ard.2009.114264.
- Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082.
- Olson AL, Swigris JJ, Sprunger DB, et al. Rheumatoid Arthritis–Interstitial Lung Disease–associated Mortality. Am J Respir Crit Care Med. 2011;183:372–378.
- Yazisiz V, Göçer M, Erbasan F, et al. Survival analysis of patients with Sjögren’s syndrome in Turkey: a tertiary hospital-based study. Clin Rheumatol. 2020;39(1):233–241.
- Chan C, Ryerson CJ, Dunne JV, et al. Demographic and clinical predictors of progression and mortality in connective tissue disease-associated interstitial lung disease: a retrospective cohort study. BMC Pulm Med. 2019;19(1):192. doi: 10.1186/ s12890-019-0943-2.
- Walsh SLF, Sverzellati N, Devaraj A, et al. Connective tissue disease related fibrotic lung disease: high resolution computed tomographic and pulmonary function indices as prognostic determinants. Thorax. 2014;69(3):216–222.
- Adegunsoye A, Oldham JM, Bellam SK, et al. Computed Tomography Honeycombing Identifies a Progressive Fibrotic Phenotype with Increased Mortality across Diverse Interstitial Lung Diseases. Ann Am Thorac Soc. 2019;16:580–588.
- Paschalaki KE, Jacob J, Wells AU, et al. Monitoring of Lung Involvement in Rheumatologic Disease. Respiration. 2016;91:89–98.
- Geerts S, Wuyts W, de Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Dif. 2017;34:326–335.
- Kolb M, Bondue B, Pesci A, et al. Acute exacerbations of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180071.
- Song JW, Hong S-B, Lim C-M, et al. Acute exacerbation of idiopathic pulmonary fibrosis: incidence, risk factors and outcome. Eur Respir J. 2011;37(2):356–363.
- Song JW, Lee H, Lee C, et al. Clinical Course and outcome of rheumatoid arthritis-related usual interstitial pneumonia. Sarcoidosis Vasc Dif. 2013;30:103–112.
- Tomiyama F, Watanabe R, Ishii T, et al. High Prevalence of Acute Exacerbation of Interstitial Lung Disease in Japanese Patients with Systemic Sclerosis. Tohoku J Exp Med. 2016;239, 297–305.
- Okamoto M, Fujimoto K, Sadohara J, et al. A retrospective cohort study of outcome in systemic sclerosis-associated interstitial lung disease. Respiratory Investigation. 2016;54, 445–453.
- Collard HR, Ryerson CJ, Corte TJ, et al. Acute Exacerbation of Idiopathic Pulmonary Fibrosis – An International Working Group Report. Am J Respir Crit Care Med. 2016;194:265–275.
- Suda T, Kaida Y, Nakamura Y, et al. Acute exacerbation of interstitial pneumonia associated with collagen vascular diseases. Resp Med. 2009;103:846–853.
- Cao M, Sheng J, Qiu X, et al. Acute exacerbations of fibrosing interstitial lung disease associated with connective tissue diseases: a population-based study. BMC Pulm Med. 2019;19:215.
- Mittoo S, Frankel S, LeSage D, et al. Patient perspectives in OMERACT provide an anchor for future metric development and improved approaches to healthcare delivery in connective tissue disease related interstitial lung disease (CTD-ILD). Curr Respir Med Rev. 2015;11:175–183.
- Saketkoo LA, MMittoo S, Huscher D, et al. Connective tissue disease related interstitial lung diseases and idiopathic pulmonary fibrosis: provisional core sets of domains and instruments for use in clinical trials. Thorax. 2014;69(5):428–436.
- Saketkoo LA, Scholand MB, Lammi MR, et al. Patient-reported outcome measures in systemic sclerosis–related interstitial lung disease for clinical practice and clinical trials. Scleroderma Relat Disord. 2020;5(2 Suppl):48–60.
- Morisset J, Dubé B, Garvey C, et al. The Unmet Educational Needs of Patients with Interstitial Lung Disease: Setting the Stage for Tailored Pulmonary Rehabilitation. Ann Am Thorac Soc. 2016;13:1026–1033.
- Swigris JJ, Brown KK, Abdulqawi R, et al. Patients’ perceptions and patient-reported outcomes in progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180075. doi: 10.1183/16000617.0075-2018.
- Chowaniec M, Skoczyńska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
- Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
- Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10:728–739.
