Impactul
PID-AR
Pneumopatia interstițială difuză (PID) triplează riscul de deces la pacienții cu AR și le reduce calitatea vieții de zi cu zi1–3

PID ESTE CAUZA PRINCIPALĂ DE DECES LA PACIENȚII CU AR4-6 – ÎNREGISTRÂND PÂNĂ LA 35% DIN DECESE7–10
PID este pe locul al doilea după bolile cardiovasculare ca principală cauză a deceselor cauzate de AR și are o tendință crescătoare6,10
~35% dintre pacienții cu PID-AR prezintă probabilitatea de deces din cauza PID8
PID a fost cea mai frecventă cauză anuală medie de deces la pacienții cu PID-AR într-o populație din SUA între 1988-20048
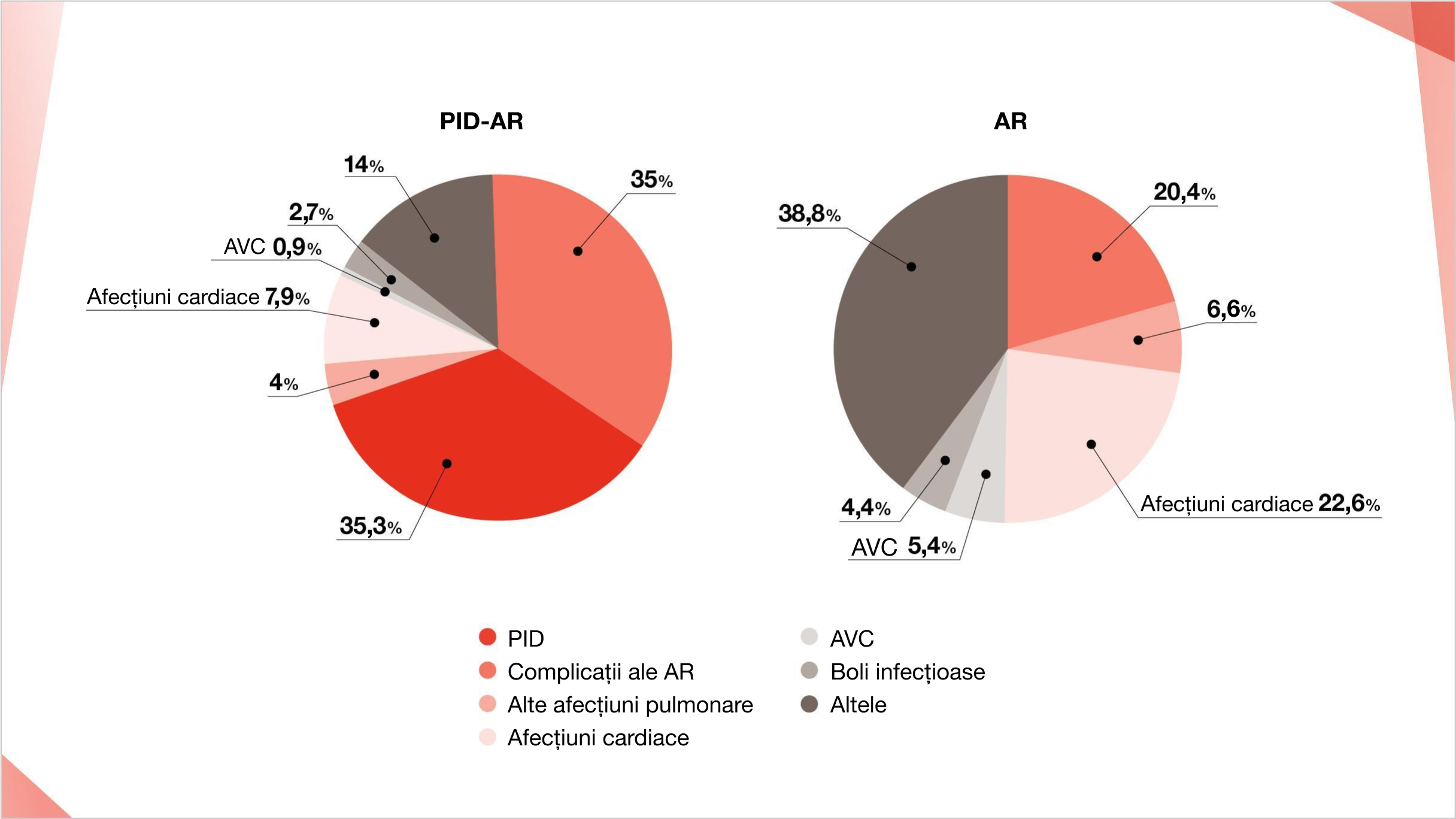
Cauza principală anuală medie de deces pentru pacienții cu PID-AR (n=10.725) și AR (n=151.322) în Statele Unite pe întreaga perioadă de studiu 1988-2004.8
RISCUL DE MORTALITATE SE TRIPLEAZĂ LA PACIENȚII CU AR CARE DEZVOLTĂ PID1
Pacienții cu PID-AR au o supraviețuire semnificativ mai proastă decât cei fără PID în SUA1*
În SUA, riscul de deces la pacienții cu AR și PID crește de ~3 ori față de cei fără PID (HR 2,86; 95% CI: 1,98, 4,12)1
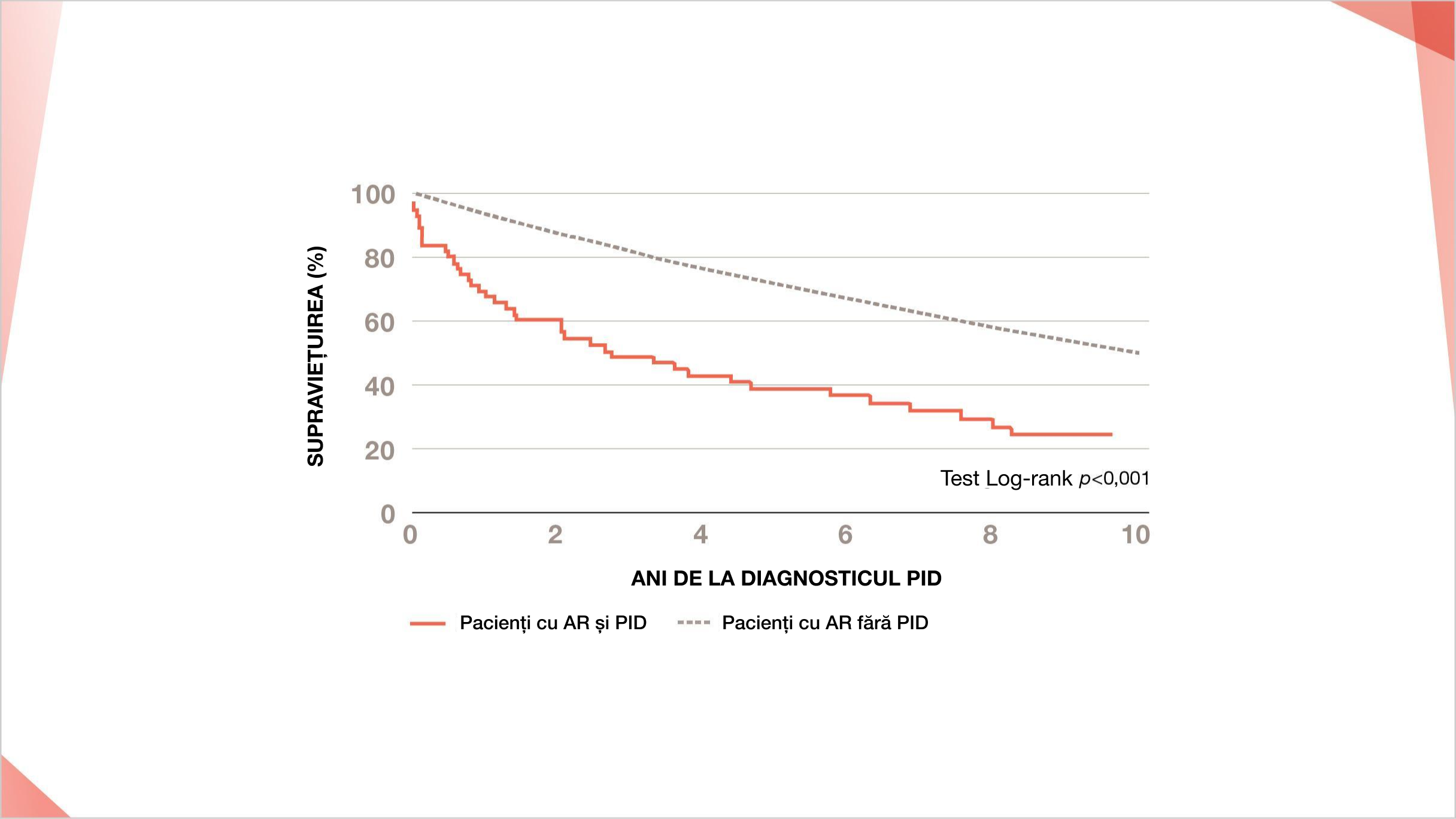
Curba Kaplan-Meier care arată rata de supraviețuire de la diagnosticul PID la pacienții cu AR cu PID vs. cei fără PID1
* După ajustarea pentru vârstă, sex și fumat (HR=2,86; 95% CI=1,98, 4,12; p<0,001).
Incidența și mortalitatea pneumopatiei interstițiale difuze în artrita reumatoidă: un studiu populațional. Bongartz T, Nannini C, Medina-Velasquez YF, et al. Copyright © 2022, Arthritis Rheum.
Reprodus cu permisiunea John Wiley & Sons Inc.
39% DIN PACIENȚII PID-AR POT DECEDA ÎN 5 ANI DE LA DIAGNOSTIC5
Pacienții cu PID-AR au o rată mai mare a mortalității la 1, 5 și 10 ani față de pacienții cu AR fără PID în Europa5
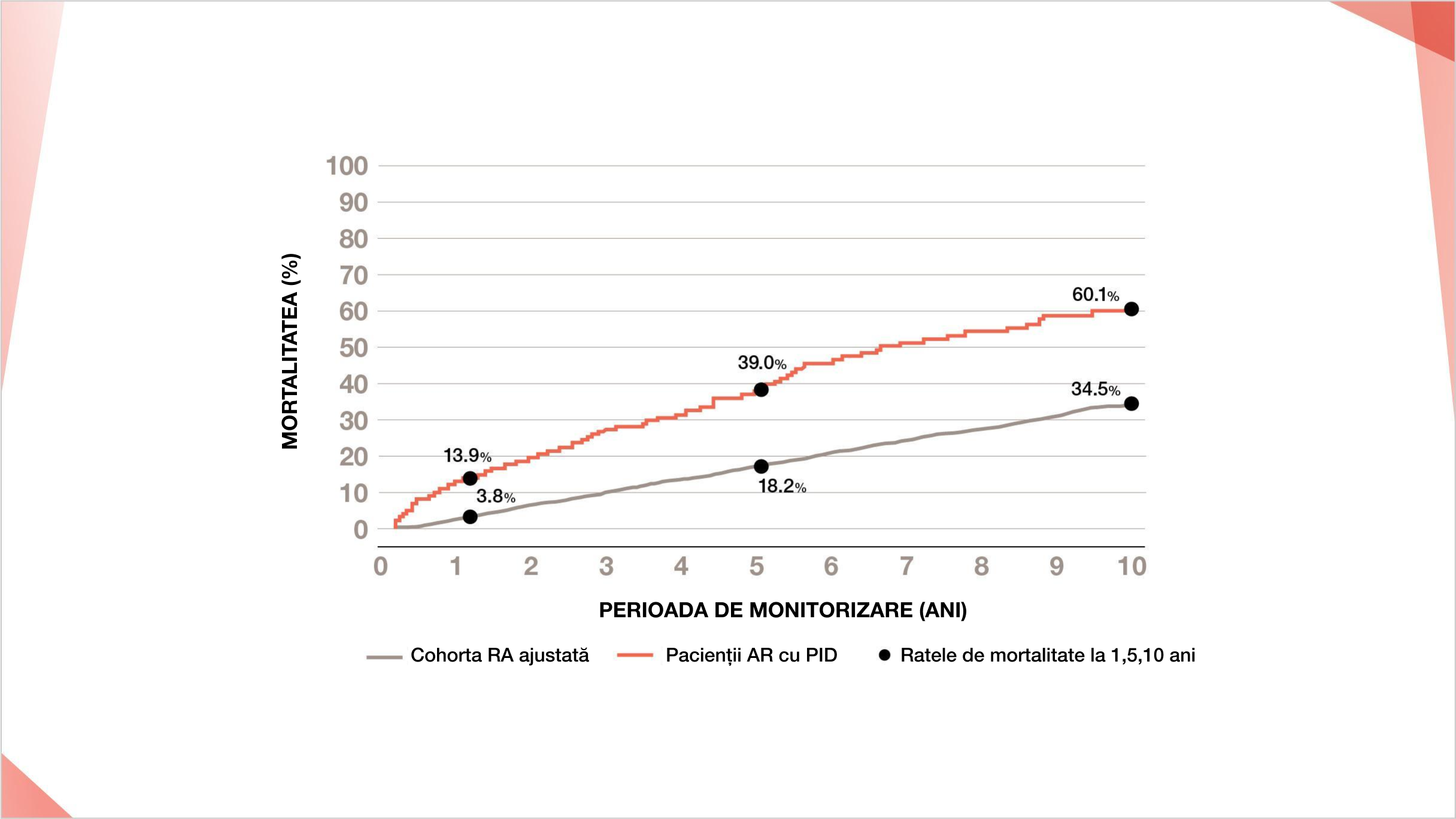
Curba Kaplan-Meier care arată mortalitatea la pacienții cu PID-AR față de pacienții cu AR fără PID (ajustată în funcție de vârstă, sex și momentul diagnosticării AR într-un studiu danez)5
Reprodus după Annals of the Rheumatic Diseases, Hyldgaard et al, 76(10),700-1706, ©2022 cu permisiunea BMJ Publishing Group Ltd.
APARIȚIA PID LA PACIENȚII CU AR POATE REDUCE SEMNIFICATIV SUPRAVIEȚUIREA CU 7,3 ANI VS. PACIENȚII CU AR FĂRĂ PID1
Supraviețuirea medie pentru pacienții cu AR în ansamblu este de 9,9 ani față de supraviețuirea medie de 2,6 ani după diagnosticul PID1,6
Pacienții cu PID-AR pot trăi doar între 2,6 și 7,8 ani după diagnostic1,6,11
VÂRSTA AVANSATĂ, SEXUL MASCULIN ȘI SEVERITATEA AFECTĂRII FUNCȚIEI PULMOANRE, SUNT PREDICTORI DE MORTALITATE CRESCUTĂ LA PACIENȚII PID-AR12-15
Factorii de risc pentru mortalitate în PID-AR | |
|---|---|
| Vârsta |
|
| Sex |
|
| Patternul HRCT și gradul de extindere al leziunilor | |
| PFR |
|
| Istoricul bolii |
|
O valoare inițială mai scăzută a CVF % din valoarea prezisă este asociată independent cu un risc crescut de deces în PID-AR (HR 1,46; p<0,0001)15
O scădere cu 10% a % CVF din valoarea prezisă față de valoarea inițială crește riscul de mortalitate la pacienții cu PID-AR de 2,5 ori (HR 2,57; p<0,0001)15
Scăderea cu 10% a CVF și/sau scăderea >15% a DLCO sunt asociate cu o supraviețuire redusă la pacienții cu PID-AR cu model UIP pe HRCT20
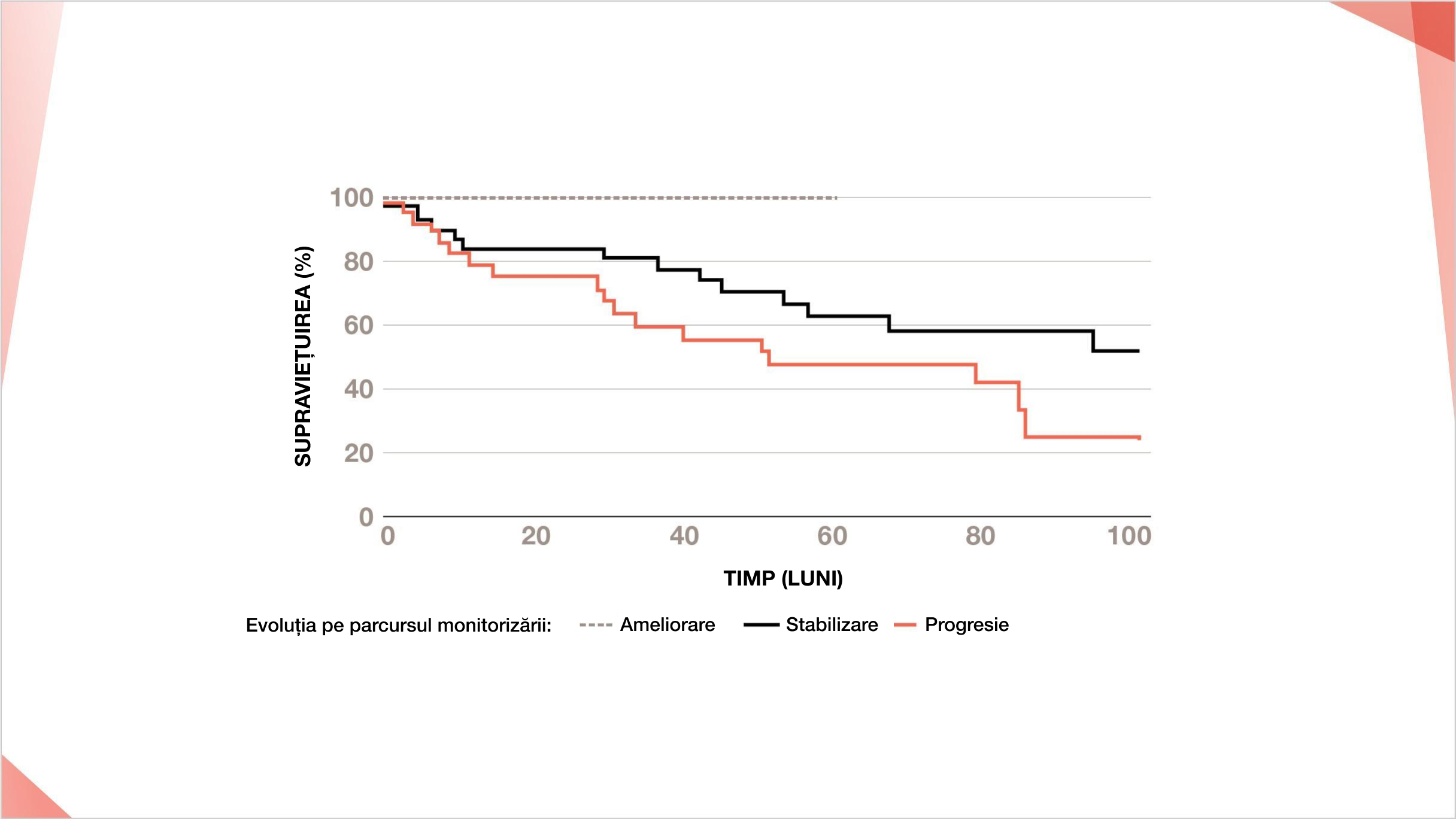
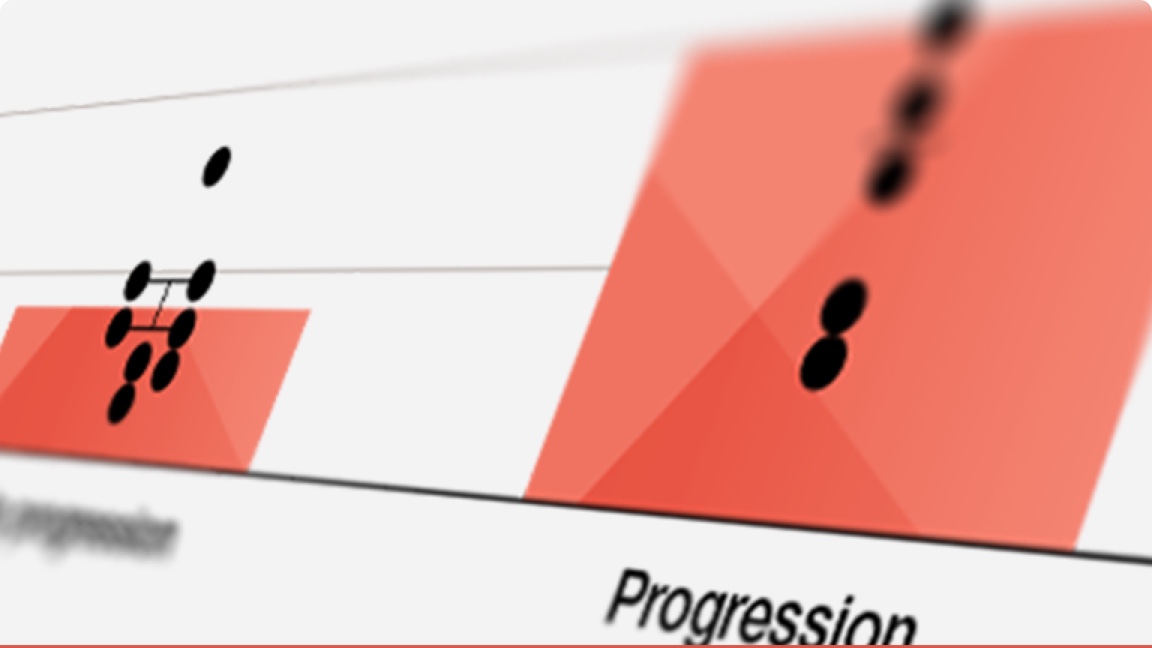
Comparația curbelor de supraviețuire în rândul pacienților cu PID-AR cu model UIP pe HRCT cu diferite evoluții pe parcursul monitorizării20
Ameliorare (n=5), stabilizare (n=37), progresie (n=28).
Ameliorarea și progresia au fost definite ca modificare respectiv de >10% a CVF și/sau modificarea >15% a DLCO.
Adaptat după Song JW, et al. Sarcoidosis Vasc Diffuse Lung Dis. 2013;30:103–112.
Pacienții cu PID-AR și aspect radiologic de fagure de miere prezintă o supraviețuire mai slabă decât cei fără acest aspect (p=0,024)12
Pacienții cu PID-AR care dezvoltă un aspect de fagure de miere pe HRCT pulmonar se confruntă cu o supraviețuire slabă, indiferent de modelul HRCT la diagnostic12,19
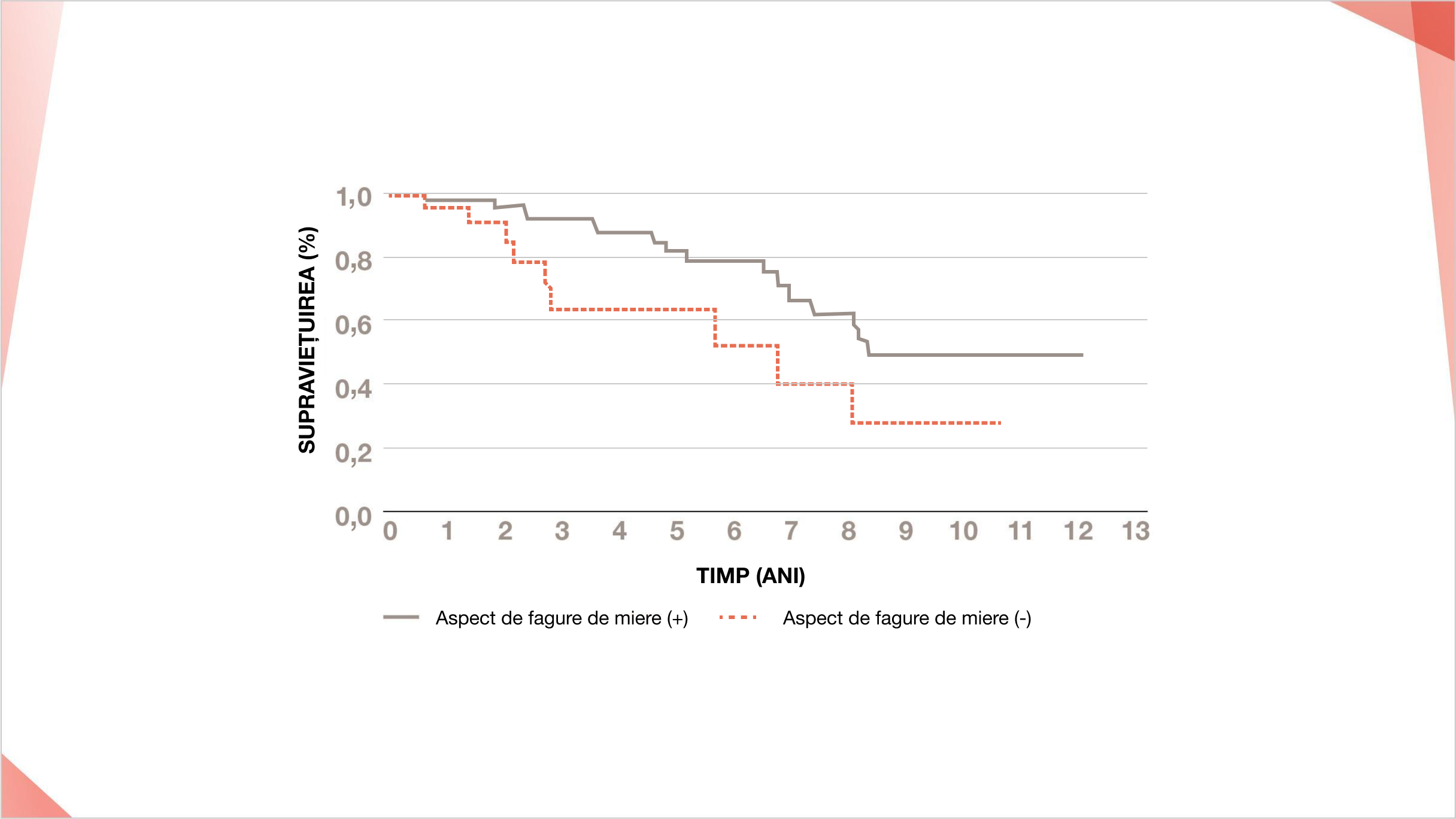
Curbele de supraviețuire Kaplan-Meier ale mortalității de toate cauzele.
Folosit cu permisiunea Nancy International Ltd Subsidiary AME Publishing Company, from Journal of Thoracic Disease, Yamakawa et al, 11(12), ©2022; permisiune acordată prin intermediul Copyright Clearance Center, Inc.
EXACERBAREA ACUTĂ A PID ESTE ADESEA FATALĂ LA PACIENȚII CU PID-AR9,12,20,21
Exacerbarea acută a PID la pacienții cu PID-AR cu model UIP pe HRCT are un prognostic foarte prost20
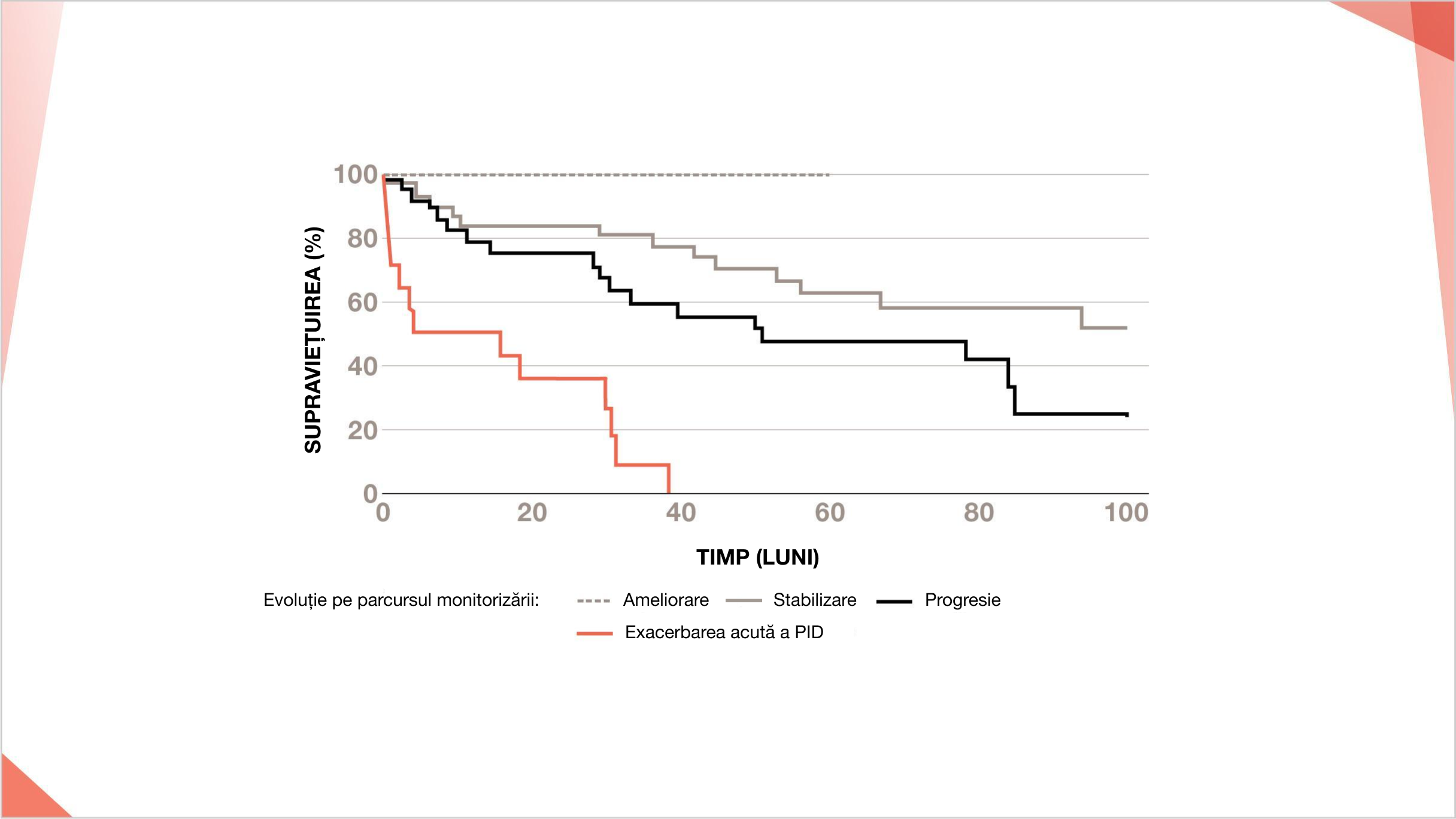
Comparația curbelor de supraviețuire în rândul pacienților cu PID-AR cu model UIP pe HRCT cu evoluție diferită pe parcursul perioadei de monitorizare20
Ameliorare (n-5), stabilizare (n-37), progresie (n-28), exacerbare acută a PID (n-14).
Îmbunătățirea și progresia au fost definite ca fiind de > 10%, respectiv, modificarea CVF și/sau modificarea de 15% a DLCO.
Adaptat după: Song JW. et al Sarcoldosis Vasc Diffuse Lung Dis. 2013;30:103-112.
Exacerbarea acută a PID ca primă manifestare a PID-AR este frecventă20, cu risc crescut de deces în decurs de 30 de zile de la diagnosticul PID, în unele cazuri, fiind din cauza exacerbării acute a PID nediagnosticată anterior:5

17% dintre pacienții cu PID-AR au prezentat exacerbare acută a PID la peste 33 de luni de la diagnostic, rezultate obținute într-o revizuire retrospectivă sud-coreeană a 84 de pacienți cu PID-AR20

Într-un studiu sud-coreean, la 93% (13/14) dintre pacienți cu PID-AR care au prezentat o exacerbare acută a PID a survenit decesul în decurs de 1,5 luni20

Într-un studiu danez, 21% dintre decesele cauzate de PID-AR au fost cauzate de exacerbarea acută a PID, majoritatea acestora având loc în primul an de monitorizare9

Într-un studiu japonez, la 80% dintre pacienții cu PID-AR cu UIP sau NSIP/UIP și antecedente de exacerbare acută a PID a survenit decesul, fără a se recupera mai întâi12
SEVERITATEA DISPNEEI REDUCE CALITATEA VIEȚII DE ZI DE ZI A PACIENȚILOR CU PID-AR2,3
Gradul de severitatea al fatigabilității și al dispneei s-a dovedit a fi cel mai strâns asociat cu afectarea sănătății fizice la pacienții cu PID-AR3.
Gradul de severitate al tusei, fatigabilității și dispneea s-au dovedit a fi cei mai puternici predictori ai afectării sănătății mintale la pacienții cu PID-AR3
PID poate afecta viața de zi cu zi a pacienților cu AR3
Deteriorarea sănătății mentale
Deteriorarea sănătății fizice
Dispneea afectează în mod semnificativ funcționarea de zi cu zi și starea generală* la pacienții cu PID-BTC, inclusiv PID-AR.2 Agravarea desaturării oxigenului poate necesita oxigenoterapie suplimentară pentru pacienții cu PID.10 Pacienții cu PID care necesită oxigenoterapie suplimentară o asociază cu frica de dependență, interferența cu stilul de viață și restrângerea activităților fizice.22
Cum puteți identifica, monitoriza și gestiona PID la pacienții cu AR?

Screeningul PID în AR
Diagnosticul PID-AR
Monitorizarea și managementul progresiei PID în PID-AR
Note
-
* Evaluat folosind MDHAQ.2
CCP, peptidă citrulinată ciclică; CI, interval de încredere; PID-BTC, pneumopatie interstițială difuză asociată cu boli ale țesutului conjunctiv; AVC, accident cerebrovascular; DLCO, factorul de transfer gazos pentru monoxid de carbon; HR, hazard ratio; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză; MDHAQ, chestionar de evaluare a sănătății multidimensionale; NSIP; pneumopatie interstițială nespecifică; PFR, probe funcționale respiratorii; AR; artrita reumatoidă; PID-AR, pneumopatie interstițială difuză asociată cu artrita reumatoidă; CPT, capacitatea pulmonară totală; UIP, pneumopatie interstițială uzuală; SUA, Statele Unite.
- Bongartz T, Nannini C, Medina-Velasquez YF, et al. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum. 2010;62(6):1583–1591.
- Swigris JJ, Yorke J, Sprunger DB, et al. Assessing dyspnea and its impact on patients with connective tissue disease-related interstitial lung disease. Respir Med. 2010;104(9):1350–1355.
- Natalini JG, Swigris JJ, Moriset J, et al. Understanding the determinants of health related quality of life in rheumatoid arthritis-associated interstitial lung disease. Respir Med. 2017;127:1–6.
- Young A, Koduri G, Batley M, et al. Mortality in rheumatoid arthritis. Increased in the early course of disease, in ischaemic heart disease and in pulmonary fibrosis. Rheumatology (Oxford). 2007;46(2):350–357.
- Hyldgaard C, Hilberg O, Pedersen AB, et al. A population-based cohort study of rheumatoid arthritis-associated interstitial lung disease: comorbidity and mortality. Ann Rheum Dis. 2017;76(10):1700–1706.
- Raimundo K, Solomon JJ, Olson AL, et al. Rheumatoid arthritis – interstitial lung disease in the United States: prevalence, incidence, and healthcare costs and mortality. J Rheumatol. 2019;46(4):360–369.
- Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082.
- Olson AL, Swigris JJ, Sprunger DB, et al. Rheumatoid arthritis-interstitial lung disease associated mortality. Am J Respir Crit Care Med. 2011;183(3):372-378.
- Hyldgaard C, Ellingsen T, Hilberg O, et al. Rheumatoid arthritis-associated interstitial lung disease: clinical characteristics and predictors of mortality. Respiration. 2019;98(5):455–460.
- Iqbal K and Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
- Kelly CA, Saravanan V, Nisar M, et al. Rheumatoid arthritis-related interstitial lung disease: associations, prognostic factors and physiological and radiological characteristics – a large multicentre UK study. Rheumatology (Oxford). 2014;53(9):1676–1682.
- Yamakawa H, Sato S, Tsumiyama E, et al. Predictive factors of mortality in rheumatoid arthritis-associated interstitial lung disease analysed by modified HRCT classification of idiopathic pulmonary fibrosis according to the 2018 ATS/ERS/JRS/ALAT criteria. J Thorac Dis. 2019;11(12):5247–5257.
- Koduri G, Norton S, Young A, et al. Interstitial lung disease has a poor prognosis in rheumatoid arthritis: results from an inception cohort. Rheumatology (Oxford). 2010; 49(8):1483–1489.
- Assayag D, Lubin M, Lee JS, King TE, Collard HR, Ryerson CJ. Predictors of mortality in rheumatoid arthritis-related interstitial lung disease. Respirology. 2014;19(4):493–500.
- Solomon JJ, Chung JH, Cosgrove GP, et al. Predictors of mortality in rheumatoid arthritis-associated interstitial lung disease. Eur Respir J. 2016;47(2):588–596.
- Kim EJ, Elicker BM, Maldonado F, et al. Usual interstitial pneumonia in rheumatoid arthritis-associated interstitial lung disease. Eur Respir J. 2010;35(6):1322–1328.
- Singh N, Varghese J, England BR, et al. Impact of the pattern of interstitial lung disease on mortality in rheumatoid arthritis: A systematic literature review and meta-analysis. Semin Arthritis Rheum. 2019;49(3):358–365.
- Tsuchiya Y, Takayanagi N, Sugiura H, et al. Lung diseases directly associated with rheumatoid arthritis and their relationship to outcome. Eur Respir J. 2011;37(6):1411–1417.
- Yamakawa H, Sato S, Nishizawa T, et al. Impact of radiological honeycombing in rheumatoid arthritis-associated interstitial lung disease. BMC Pulm Med. 2020;20(1):25.
- Song JW, Lee HK, Lee CK, et al. Clinical course and outcome of rheumatoid arthritis-related usual interstitial pneumonia. Sarcoidosis Vasc Diffuse Lung Dis. 2013;30(2):103–112.
- Hozumi H, Nakamura Y, Johkoh T, et al. Acute exacerbation in rheumatoid arthritis associated interstitial lung disease: a retrospective case control study. BMJ Open. 2013;13(9): e003132. doi: 10.1136/bmjopen-2013-003132.
- Khor YH, Goh NSL, McDonald CF, Holland AE. Oxygen therapy for interstitial lung disease. A mismatch between patient expectations and experiences. Ann Am Thorac Soc. 2017;14(6):888–895.
- Esposito AJ, Chu SG, Madan R, et al. Thoracic manifestations of rheumatoid arthritis. Clin Chest Med. 2019;40(3):545–560.
- Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
- Kawano-Dourado L, Doyle TJ, Bonfiglioli K, et al. Baseline characteristics and progression of a spectrum of interstitial lung abnormalities and disease in rheumatoid arthritis. Chest. 2020:S0012-3692(20)31412-4. doi: 10.1016/j.chest.2020.04.061.
