Monitorizarea continuă în PID-ScS
Evoluția foarte variabilă a penumopatiei interstițiale difuze asociate sclerozei sistemice (PID-ScS) necesită o monitorizare continuă și regulată pentru a asigura intervenția precoce împotriva progresiei bolii1–4

FACTORI DE RISC PENTRU PROGRESIA PID ÎN PID-ScS
Sex |
|
|---|---|
Vârsta |
|
Durata bolii |
|
Gradul de extindere al bolii |
|
Subtipul ScS |
|
CVF | |
DLCO |
|
Serologie | |
| Afectarea cutanată |
|
Simptome de reflux/disfagie |
|
Principalii factori de risc pentru progresia PID sunt sexul masculin, subtipul ScSdc, prezența anticorpilor anti-topoizomerază I, o valoare CVF <70% și gradul de fibroză la momentul inițial.19 Într-o analiză a bazei de
date EUSTAR din 2020, CVF, prezența simptomelor de reflux/disfagie și mRSS la momentul inițial au fost predictive pentru progresia semnificativă a PID în primele 12±3 luni.1
MONITORIZAREA PROGRESIEI PID ÎN PID-ScS
PID-ScS prezintă rate heterogene de progresie, dar este fundamental progresivă pe termen lung.1,20
PID-ScS prezintă modele foarte variabile de progresie pe o perioadă de 5 ani1
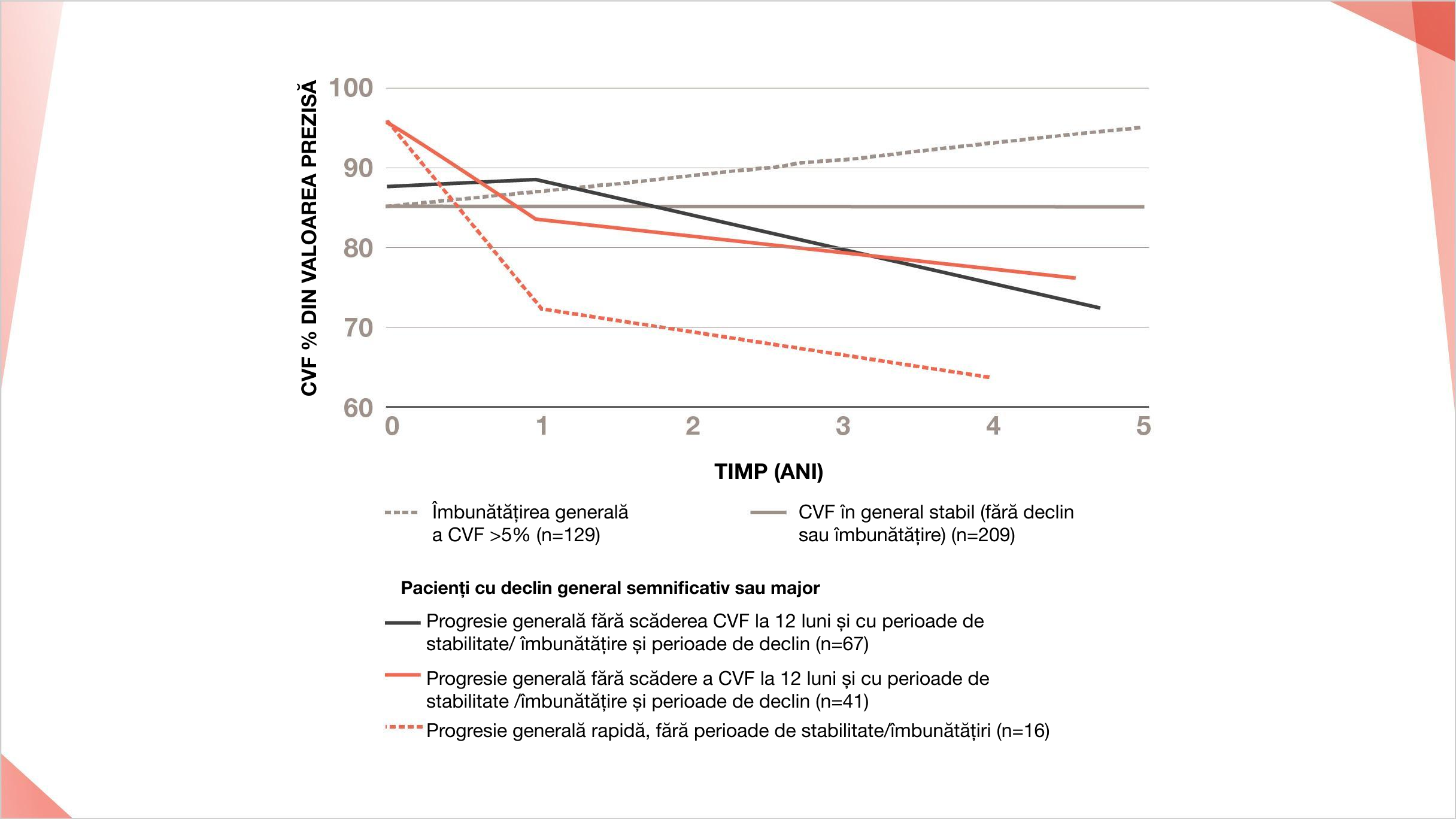
Modele variabile de evoluție a bolii pentru pacienții cu PID-ScS în baza de date EUSTAR, bazate pe magnitudinea modificărilor FVC (% din valoarea prezisă) la pacienții individuali de la momentul inițial până la sfârșitul perioadei de monitorizare de 5 ani.
Adaptat după Hoffmann-Vold A-M, et al. Ann Rheum Dis 2020. Epub ahead of print dol: 10.1138/annrheumdis-2020-217455.

Toți pacienții cu PID-ScS trebuie urmăriți la fiecare 3-6 luni cu PFR și HRCT repetat conform deciziei clinice, având în vedere evoluția foarte variabilă a bolii3,4
Procentul estimat al valorilor CVF, DLCO, gradul de fibroză observat la HRCT și saturația de oxigen venos indusă de efort pot indica progresia PID la pacienții cu PID-ScS3

HRCT trebuie efectuată la toți pacienții cu PID-ScS în cazul rezultatelor anormale ale PFR și/sau dacă se suspectează progresia simptomelor6,21
CUM PUTEȚI EFECTUA MONITORIZARE REGULATĂ CONTINUĂ A PID LA PACIENȚII DVS. CU PID-ScS?
Algoritm de monitorizare pentru PID-ScS3
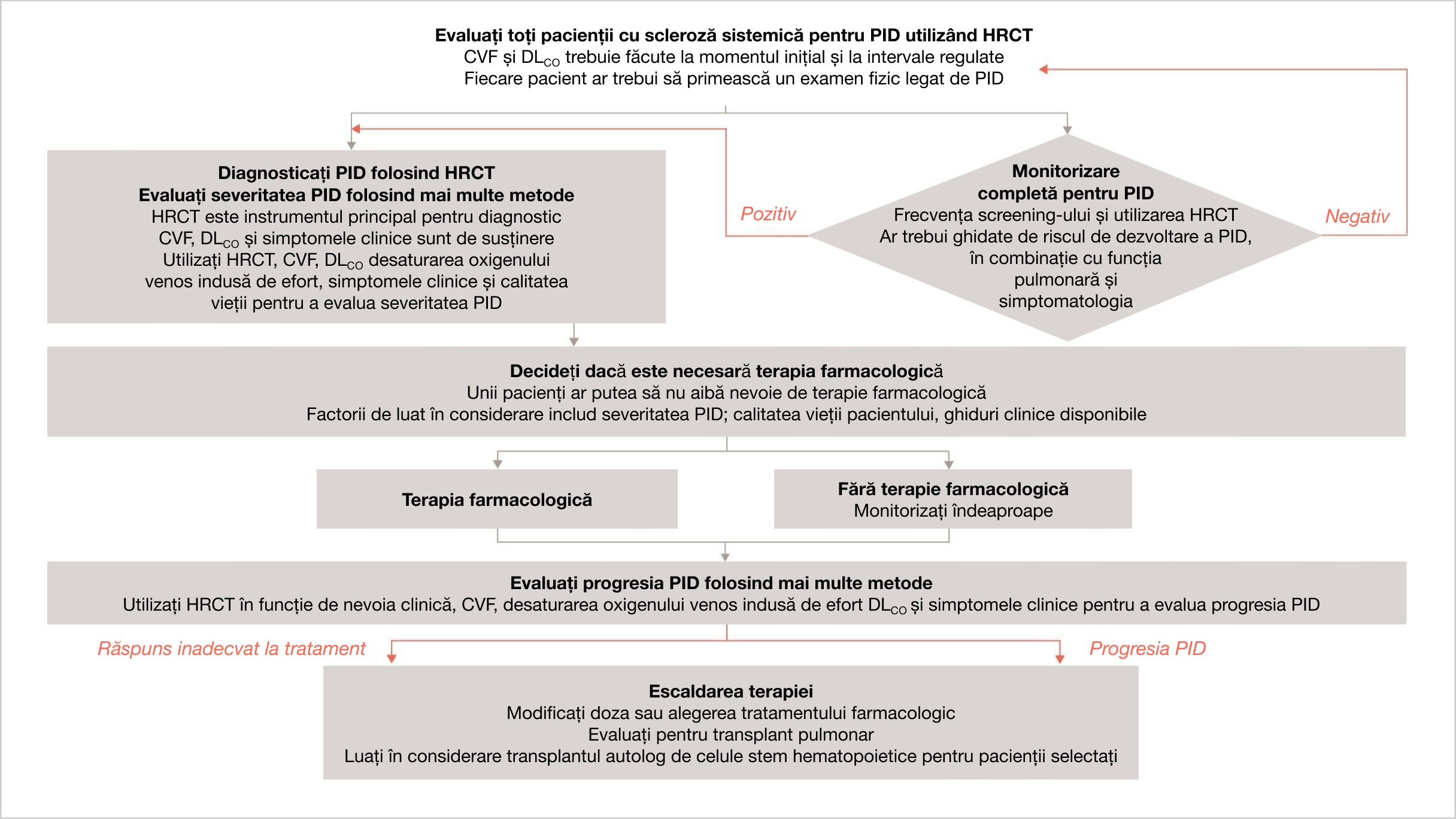
Acest algoritm oferă un scurt rezumat al declarațiilor de consens european bazate pe dovezi, inclusiv procesul suplimentar Delphi, din opinia experților a comitetului de coordonare pentru identificarea și gestionarea PID-ScS, pentru utilizare în practica clinică.
Adaptat după Hoffmann-Vold AM, et al. Lancet Rheum. 2020;2:e71-e83.
Ce opțiuni de management ar trebui să luați în considerare pentru pacienții dumneavoastră cu PID-ScS?

Managementul PID-ScS

Oferirea de îngrijiri paliative/ de susținere

Echipa multidisciplinară
Note
-
CCL-18, chemokină (model C-C) ligand-18; CRP, proteină C-reactivă; PID-BTC, pneumopatie interstițială difuză asociată cu boli ale țesutului conjunctiv; ScScd, scleroză sistemică cutanată difuză; DLco, factorul de transfer gazos pentru monoxid de carbon; EUSTAR, European League Against Rheumatism Scleroderma Trials and Research; CVF, capacitate vitală forțată; RGE, reflux gastroesofagian; HRCT, tomografie computerizată de înaltă rezoluție; IL-6, interleukină-6; PID, pneumopatie interstițială difuză; KL-6, Krebs von den Lungen-6; mRSS, scorul de piele Rodnan modificat; PFR, probe funcționale respiratorii; scl-70, sclerodermie 70 kDa; ScS, scleroză sistemică; PID-ScS pneumopatie interstițială difuză asociată sclerozei sistemice.
- Hoffmann-Vold AM, Allanore Y, Alves M, et al. Progressive interstitial lung disease in patients with systemic sclerosis- associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020. Epub ahead of print: doi:10.1136/annrheumdis-2020-217455.
- Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200;1258–1266.
- Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. Lancet Rheum. 2020;2 e71–e83.
- Distler O, Assassi S, Cottin V, et al. Predictors of progression in systemic sclerosis patients with interstitial lung disease. Eur Respir J. 2020;55;1902026.
- Winstone T, Assayag D, Wilcox P, et al. Predictors of mortality and progression in scleroderma-associated interstitial lung disease. A systematic review. CHEST. 2014;146:422-436.
- Cappelli S, Bellando Randone S, Camiciottoli G, et al. Interstitial lung disease in systemic sclerosis: where do we stand? Eur Respir Rev. 2015;24:411–419.
- Khanna D, Tseng C, Farmani N, et al. Clinical course of lung physiology in patients with scleroderma and interstitial lung disease: analysis of the Scleroderma Lung Study Placebo Group. Arthritis Rheum. 2011;63:3078–3085.
- Asano Y, Jinnin M, Kawaguchi Y, et al. Diagnostic criteria, severity classification and guidelines of systemic sclerosis: Guideline of SSc. J Dermatol. 2018;45:633–691.
- Moore OA, Goh N, Corte T, et al. Extent of disease on high-resolution computed tomography lung is a predictor of decline and mortality in systemic sclerosis-related interstitial lung disease. Rheumatology. 2013;52:155–160.
- Nihtyanova SI, Schreiber BE, Ong VH, et al. Prediction of pulmonary complications and long–term survival in systemic sclerosis. Arthritis Rheumatol. 2014;66: 1625–1635.
- Goh NS, Desai SR., Veeraraghavan S, et al. Interstitial lung disease in systemic sclerosis: a simple staging system. Am J Respir Crit Care Med. 2008;177:1248–1254.
- Maher TM, Mayes MD, Kreuter M, et al. Effect of nintedanib on lung function in patients with systemic sclerosis-associated interstitial lung disease: further analyses of the SENSCIS trial. Arthritis Rheumatol. 2020 Nov 3. doi:10.1002/art.41576. Online ahead of print.
- Volkmann, Elizabeth R, Tashkin DP, et al. Short-term progression of interstitial lung disease in systemic sclerosis predicts long-term survival in two independent clinical trial cohorts. Ann Rheum Dis. 2019a;78:122–130.
- Khanna D, Tashkin DP, Denton CP, et al. Etiology, risk factors, and biomarkers in systemic sclerosis with interstitial lung disease. Am J Respir Crit Care Med. 2020;201:650–660.
- Liu X, Mayes MD, Pedroza, C. et al. Does C-reactive protein predict the long-term progression of interstitial lung disease and survival in patients with early systemic sclerosis? Arthritis Care Res (Hoboken). 2013;65(8):1375–1380.
- De Lauretis A, Sestini P, Pantelidis P, et al. Serum interleukin 6 is predictive of early functional decline and mortality in interstitial lung disease associated with systemic sclerosis. J Rheumatol. 2013;40(4):435–446.
- Volkmann, Elizabeth R, Tashkin DP, et al. Progression of interstitial lung disease in systemic sclerosis: the importance of pneumoproteins Krebs von den Lungen 6 and CCL18. Arthritis Rheumatol. 2019b;71:2059–2067.
- Wu W, Jordan S, Becker MO, et al. Prediction of progression of interstitial lung disease in patients with systemic sclerosis: the SPAR model. Ann Rheum Dis. 2018;77:1326–1332.
- Hoffmann-Vold A, Aaløkken TM, Lund MB, et al. Predictive Value of Serial High-Resolution Computed Tomography Analyses and Concurrent Lung Function Tests in Systemic Sclerosis. Arthritis Rheumatol. 2015;67:2205–2212.
- Guler, S.A., Winstone, T.A., Murphy, D., et al. Does systemic sclerosis–associated interstitial lung disease burn out? Specific phenotypes of disease progression. Annals ATS. 2018;15;1427–1433.
- Chowaniec M, Skoczyńska M, Sokolik R, et al. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56:249–254.
- Wells AU. Interstitial lung disease in systemic sclerosis. La Presse Médicale. 2014;43:e329–e343.
- Distler O, Volkmann ER, Hoffmann-Vold AM, et al. Current and future perspectives on management of systemic sclerosis-associated interstitial lung disease. Expert Rev Clin Immunol. 2019;15:1009–1017.
- Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
- Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
- Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
- Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
