Impactul PID-SSp
Riscul de deces se multiplică de patru ori la pacienții cu sindrom Sjögren primar (SSp) cu penumopatie interstițială difuză (PID) față de cei fără PID1

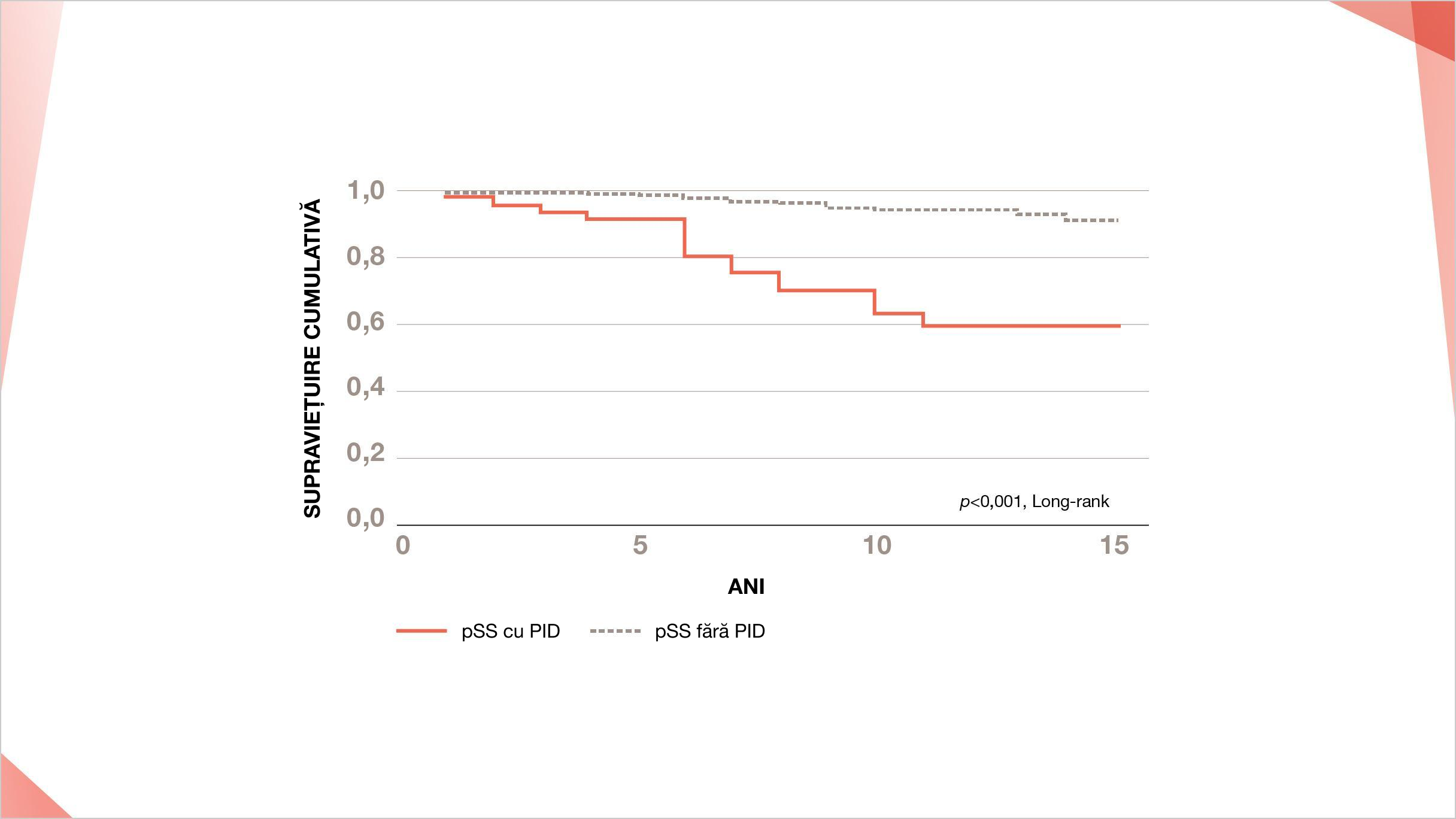
Rata de supraviețuire la 5 ani pentru toți pacienții cu PID-SSp a fost de 84%2
Timpul de supraviețuire a fost calculat ca numărul de ani de la vizita inițială pentru o consultație respiratorie până la deces sau momentul cenzurii. 33 de pacienți au fost cenzurați dacă erau în viață la 30 aprilie 2003 sau au murit înainte de acea zi dintr-o cauză care nu are legătură cu boala.
Adaptat după Ito I, et al. Am J Respir Crit Care Med. 2005;171(6):632–638.
VÂRSTA AVANSATĂ, SEXUL MASCULIN ȘI SEVERITATEA AFECTĂRII FUNCȚIEI PULMONARE SUNT FACTORI DE RISC PENTRU MORTALITATE LA PACIENȚII CU PID-SSp1,2,6
Factori de risc pentru mortalitatea în PID-SSp | |
|---|---|
Vârsta |
|
Sex |
|
Modelul și extinderea HRCT | |
PFR | Insuficiență sau scăderea funcției pulmonare (≤78% din valoarea prezisă la momentul inițial5 și un prag CVF de <60% din valoarea prezisă)6 |
Serologie |
|
Prelevarea probelor gazoase din sângele arterial | |
CVF și VEMS1 <60% din valoarea prezisă sunt asociate cu mortalitatea precoce la pacienții cu SSp cu afectare pulmonară.6 Pacienții cu niveluri CVF % mai scăzute (≤78%) la momentul inițial au o rată a mortalității semnificativ mai mare decât cei cu niveluri CVF % mai mari (p=0,02).5
Supraviețuirea a fost semnificativ mai scurtă la pacienții cu PID-SSp cu niveluri serice crescute de KL-6 (>800 U/ml) la momentul diagnosticului inițial față de cei cu niveluri de KL-6 ≤800 U/ml5.
Nivelurile serice crescute de KL-6 (>800 U/ml) aproape triplează riscul de mortalitate al pacienților cu PID-SSp (HR 2,93, 95% CI 1,04–8,10, p=0,04)5
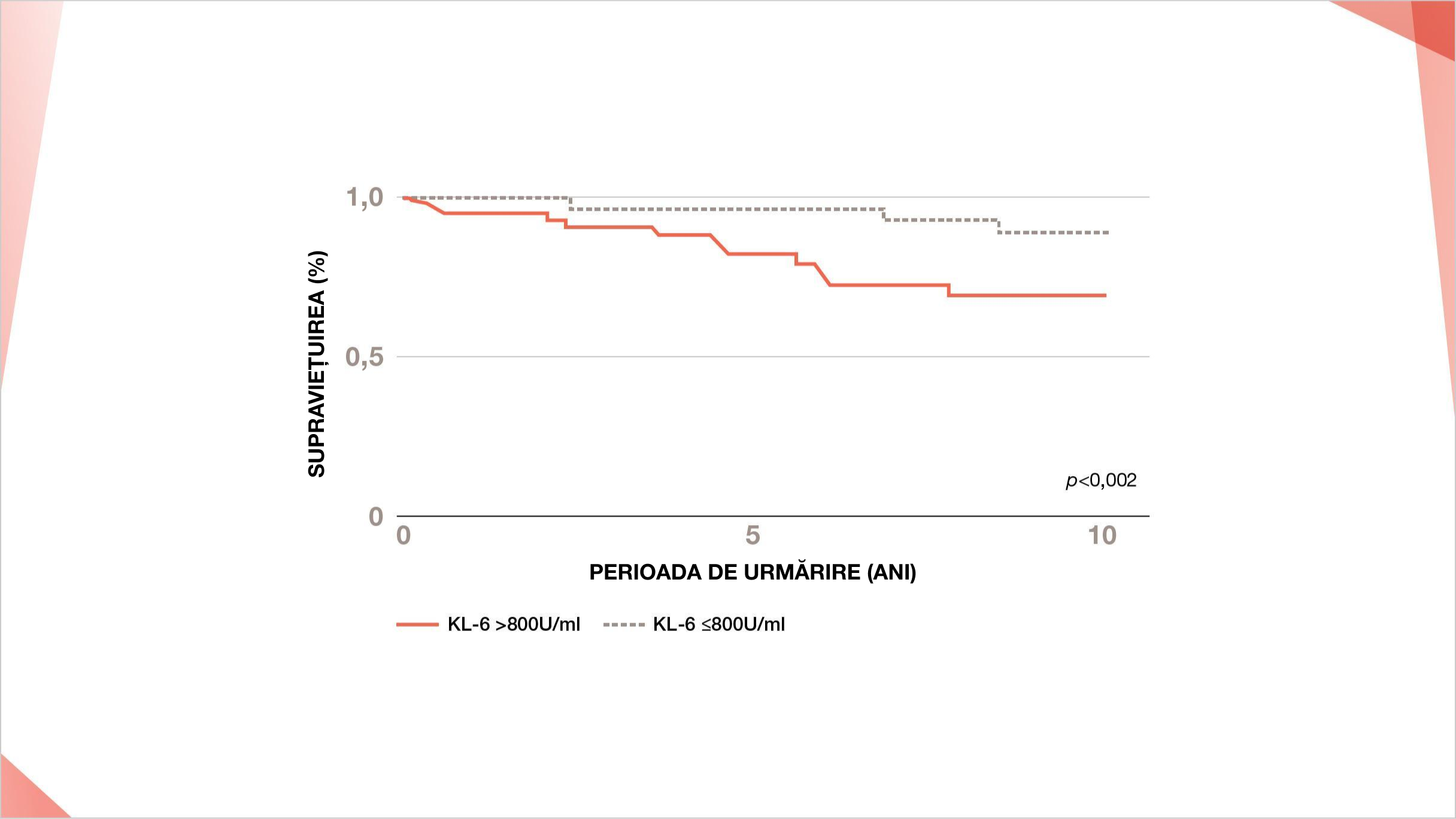
Curba de supraviețuire Kaplan-Meier pentru 99 de pacienți consecutivi cu PID-SSp diagnosticați între 1990 și 2017 într-un studiu retrospectiv japonez. Vârsta medie a pacienților a fost de 68 de ani, iar 72 (73%) dintre cei 99 de pacienți au fost femei.
Perioada mediană de urmărire a fost de 5,97 ani.
Adaptat după: Kamiya Y, et al. Respir Med. 2019;159:105811.
Pacienții cu SSp cu afectare pulmonară severă (scoruri HRCT ridicate de 13–18) au avut o supraviețuire globală mediană mai scurtă decât cei cu afectare pulmonară ușoară sau moderată (scoruri HRCT de 0–12) (p<0,001)6
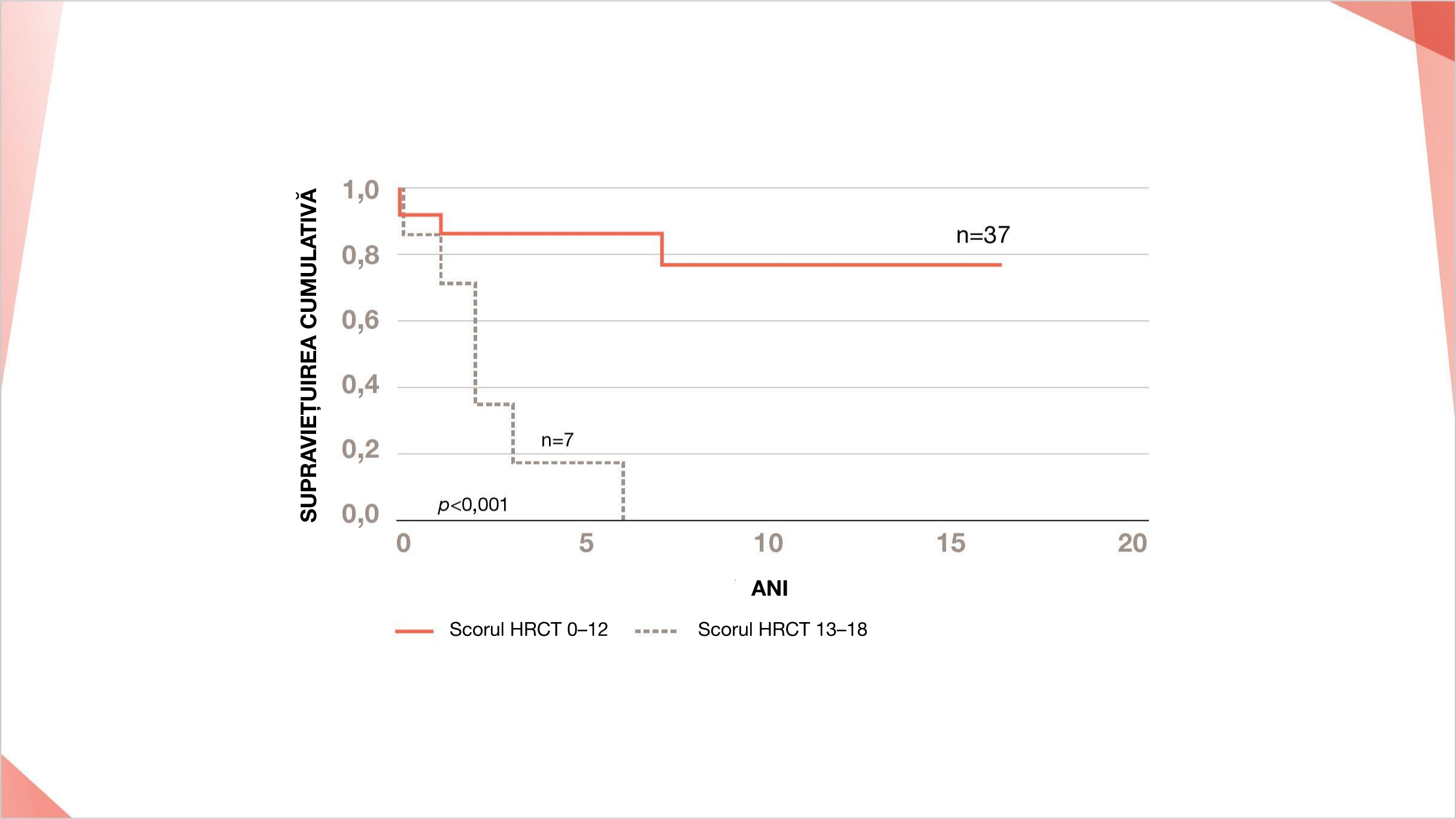
Severitatea afectării plămânilor a fost clasificată conform HRCT, unde scorurile HRCT de 0-6 au fost definite ca ușoare, 7-12 au fost definite ca moderate și 13-18 au fost definite ca severe.
Exacerbarea acută a PID în PID-SSp este rară, dar poate fi fatală3,5,7,8
În timpul unui studiu de urmărire de 38 de luni a 18 pacienți PID-SSp, 39% dintre pacienți au decedat și la 17% a survenit decesul din cauza unei exacerbari acute a PID7.
Într-un studiu retrospectiv al pacienților cu PID-SSp dovedit patologic, 3 (NSIP fibrotic, 2; UIP, 1) din 33 de pacienți au murit din cauza exacerbării acute a PID (urmărire mediană, 110 luni)3
Într-un studiu retrospectiv japonez pe 99 de pacienți cu PID-SSp, 33% dintre decese (7 din 21 de pacienți) au fost atribuite exacerbărilor acute5
Cum puteți identifica, monitoriza și gestiona PID la pacienții cu SSp?

Screeningul pentru PID-SSp
Diagnosticul PID-SSp

Monitorizarea și managementul progresiei PID în PID-SSp
Note
-
* Modificările HRCT au fost clasificate conform metodei Schurawitzki. Plămânii au fost împărțiți în segmente superioare, mijlocii și inferioare și fiecărei zone a unui segment i s-a atribuit un scor de 0-3 conform următoarei scale: 0 = fără implicare interstițială, 1 = model reticular minim, 2 = model reticular evident și 3 = aspect de fagure de miere. Scorurile obținute pentru cele șase segmente pulmonare au fost adăugate pentru a obține un scor general, care a variat de la 0 (scanări normale) la un scor maxim de valoare 1812
CI, interval de încredere; PID-BTC, pneumopatie interstițială difuză asociată cu boli ale țesutului conjunctiv; VEMS, volumul expirator forțat maxim în prima secundă; CVF, capacitate vitală forțată; HR, hazard ratio; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză; KL-6, Krebs von den Lungen-6; NSIP, pneumopatie interstițială nespecifică; PaCO2, presiunea parțială a monoxidului de carbon; PaO2, presiunea parțială a oxigenului; PFR, probe funcționale respiratorii; SSp, sindromul Sjögren primar; PID-SSp, pneumopatie interstițială difuză asociată sindromului Sjögren primar; UIP, pneumopatie interstițială uzuală.
- Yazisiz V, Göçer M, Erbasan F, et al. Survival analysis of patients with Sjögren’s syndrome in Turkey: a tertiary hospital-based study. Clin Rheumatol. 2020;39(1):233–241.
- Ito I, Nagai S, Kitaichi M, et al. Pulmonary manifestations of primary Sjögren’s syndrome: a clinical, radiologic, and pathologic study. Am J Respir Crit Care Med. 2005;171(6):632–638.
- Enomoto Y, Takemura T, Hagiwara E, et al. Prognostic factors in interstitial lung disease associated with primary Sjögren’s syndrome: a retrospective analysis of 33 pathologically-proven cases. PLoS One. 2013;8(9):e73774.
- Gao H, Zhang X-W, He J, et al. Prevalence, risk factors, and prognosis of interstitial lung disease in a large cohort of Chinese primary Sjögren syndrome patients: a case-control study. Medicine (Baltimore). 2018;97(24):e11003.
- Kamiya Y, Fujisawa T, Kono M, et al. Prognostic factors for primary Sjögren’s syndrome-associated interstitial lung diseases. Respir Med. 2019;159:105811.
- Chen M-H, Chiu H-P, Lai C-C, et al. Lung involvement in primary Sjögren’s syndrome: correlation between high-resolution computed tomography score and mortality. J Chin Med Assoc. 2014;77(2):75–82.
- Parambil JG, Myers JL, Lindell RM, et al. Interstitial lung disease in primary Sjögren syndrome. Chest. 2006;130(5):1489–1495.
- Suda T, Kaida Y, Nakamura Y, et al. Acute exacerbation of interstitial pneumonia associated with collagen vascular diseases. Respir Med. 2009;103(6):846–853.
- Lee AS, Scofield RH, Hammitt KM, et al. Consensus guidelines for evaluation and management of pulmonary disease in Sjögren’s. Chest. 2020 Oct 20. doi: 10.1016/j. chest.2020.10.011.
- Guisado-Vasco P, Silva M, Duarte-Millán M A, et al. Quantitative assessment of interstitial lung disease in Sjögren’s syndrome. PLoS One. 2019;14(11):e0224772.
- Li X, Xu B, Ma Y, et al. Clinical and laboratory profiles of primary Sjögren’s syndrome in a Chinese population: a retrospective analysis of 315 patients. Int J Rheum Dis. 2015;18(4):439–446.
- Schurawitzki H, et al. Interstitial lung disease in progressive systemic sclerosis: high-resolution CT versus radiography. Radiology. 1990;176(3):755-9.
