Monitorizarea și managementul progresiei PID în PID-AR
Monitorizarea regulată a progresiei pneumopatiei interstițiale difuze asociate poliartritei reumatoide PID-AR poate pregăti deciziile adecvate de tratament1,2

Creșterea gradului de fibroză la HRCT

Agravarea simptomelor respiratorii
Declinul funcției pulmonare
Factori de risc pentru progresia PID în PID-AR | |
|---|---|
HRCT | |
PFR | |
Biomarkeri serologici |
|
HRCT
Anomaliile pulmonare interstițiale apar la 20%–60% dintre pacienții cu AR și s-au dovedit a fi progresive radiografic în 57% din cazuri pe o perioadă de 1,5 ani.10,15
Pacienții cu PID-AR care prezintă progresie la HRCT au avut o implicare inițială mediană a PIA/PID semnificativ mai mare (p=0,001)10
Modelul UIP pe HRCT este un factor de risc pentru un prognostic mai prost în PID-AR, dar pacienții cu alte modele HRCT pot prezenta, de asemenea, progresie, așa cum s-a demonstrat într-un studiu al Clinicii Mayo11
Aflați cum să utilizați HRCT în practica clinică
Procentul de pacienți care progresează la CVF <50% prezis în funcție de timpul de la diagnosticul PID11
Nu a fost observată nicio diferență în progresia către CVF la <50% dintre pacienții cu modele UIP și NSIP într-un studiu de la Clinica Mayo11
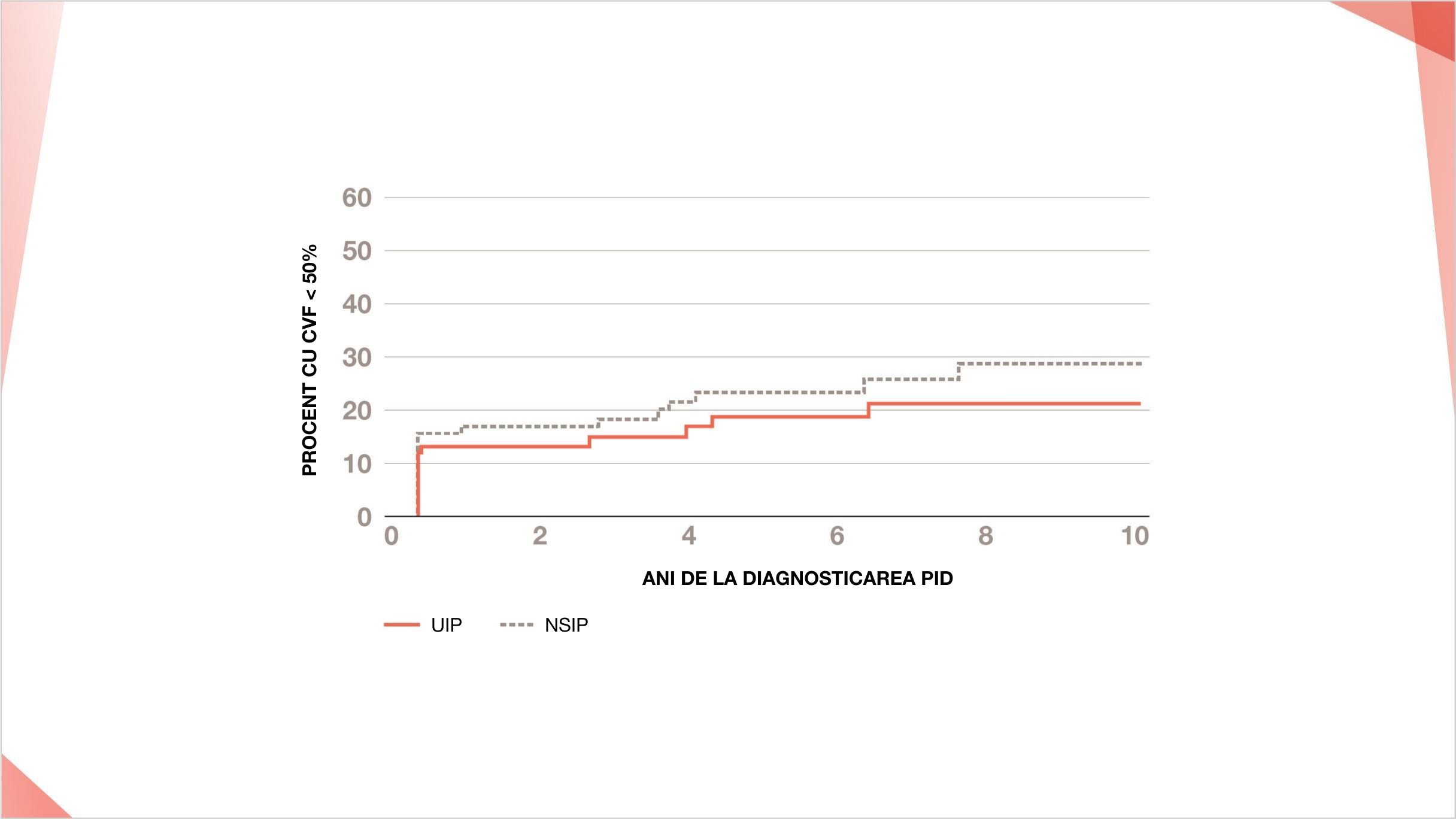
Procentul estimat de pacienți cu CVF <50% în funcție de timpul de la diagnosticarea PID la 167 de pacienți cu PID-AR subdivizați pe tipul PID.
HR: 0,86; 95% CI: 0,27, 2,73.
Progressive Decline of Lung Function in Rheumatoid Arthritis-Associated Interstitial Lung Disease, Jorge et al, ©2022, Arthritis and Rheumatology. Reprodus cu permisiunea John Wiley & Sons Inc.
Procentul de pacienți care progresează la DLCO <40% estimat în funcție de timpul de la diagnosticarea PID11
Modelul UIP a fost asociat mai semnificativ cu progresia DLCO <40% din valoarea prezisă față de modelul NSIP într-un studiu al Clinicii Mayo11
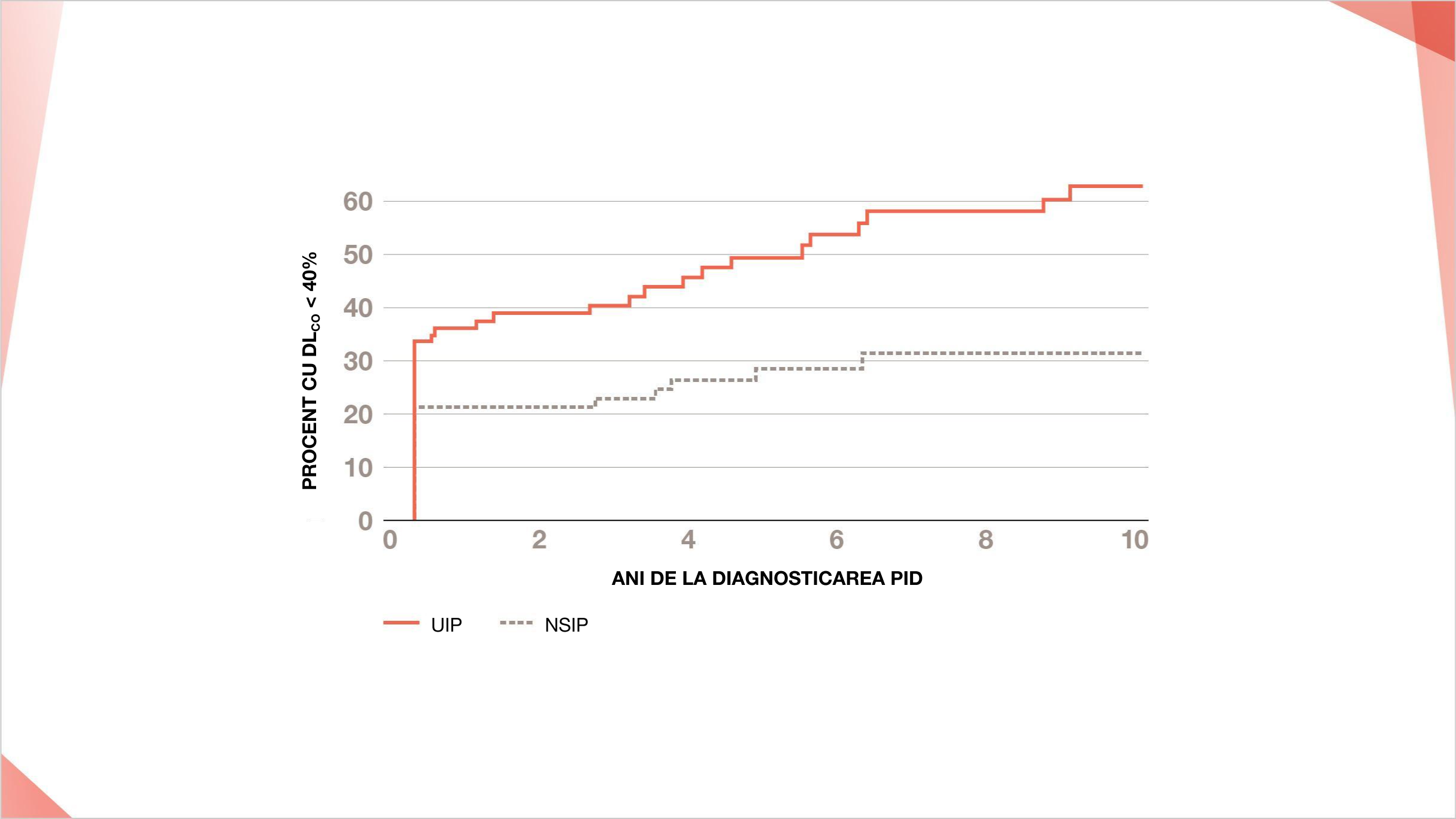
Procentul estimat de pacienți cu DLCO <40% (sau prea bolnavi pentru a efectua testul) în funcție de timpul de la diagnosticarea PID la 167 de pacienți cu PID-AR subdivizați pe tipul PID.
HR: 3,29; 95% CI: 1,28, 8,41.
Progressive Decline of Lung Function in Rheumatoid Arthritis-Associated Interstitial Lung Disease, Jorge et al, ©2022, Arthritis and Rheumatology. Reprodus cu permisiunea John Wiley & Sons Inc.
PRF
CVF și DLCO inițial scăzute la diagnosticarea PID-AR cresc riscul de progresie a PID11
CVF sau % DLCO din valoarea prezisă scăzute la momentul inițial, scăderea >10% a CVF sau scăderea >15% a DLCO în perioada de monitorizare, toate sunt asociate cu progresia PID și cu o mortalitate crescută la pacienții cu AR12,13.
O rată crescută de declin a CVF și DLCO în primele 6 luni crește riscul de progresie spre afectarea severă a funcției pulmonare11
SEROLOGIE
S-a descoperit că, concentrațiile serice inițiale ridicate de KL-6 sunt asociate cu progresia PID în PID-AR14*
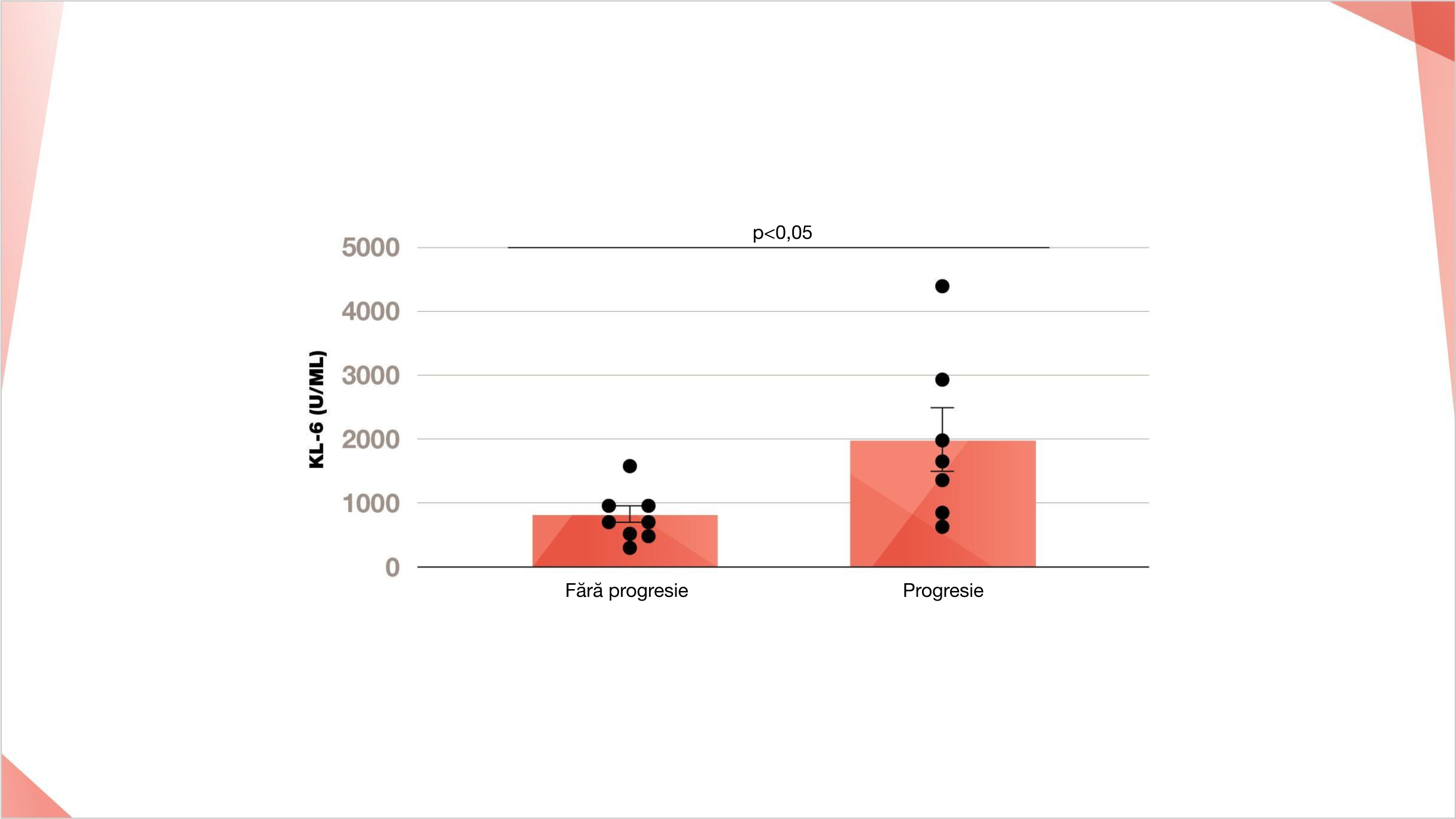
Concentrația KL-6 (U/mL) în funcție de progresia PID_AR
* După cum este definit prin progresia >10% a fibrozei la HRCT și fie o scădere a CVF >15%, fie o scădere a CVF >10% combinată cu o scădere a DLCO >15%
Reprodus după PLoS ONE, Avouac et al, 15(5), e0232978, ©2022, cu permisiunea BMJ Publishing Group Ltd.
PROGRESIA ȘI SEVERITATEA PID SUNT PRINCIPALII FACTORI DE LUAT ÎN CALCUL ÎN LUAREA DECIZIILOR TERAPEUTICE PENTRU PID-AR2
Tratamentul poate fi luat în considerare:17

Indiferent dacă modelul HRCT este UIP sau NSIP

Dacă PID este semnificativă clinic (simptome, severitate)
Dacă PID este progresivă
Tratamentul pentru PID-AR ar trebui intensificat atunci când PID progresează.18 Dacă pacientul PID-AR nu răspunde la tratamentul de primă linie sau se deteriorează, ar putea fi luate în considerare diferite opțiuni de tratament.17
SE RECOMANDĂ O ABORDARE MULTIDISCIPLINARĂ DE ECHIPĂ PENTRU LUAREA DECIZIILOR DE TRATAMENT PENTRU PID CU FENOTIP PROGRESIV LA PACIENȚII PID-AR2
Managementul multidisciplinar care include reumatologi și pneumologi are un rol esențial în optimizarea îngrijirii pacienților cu PID-AR1
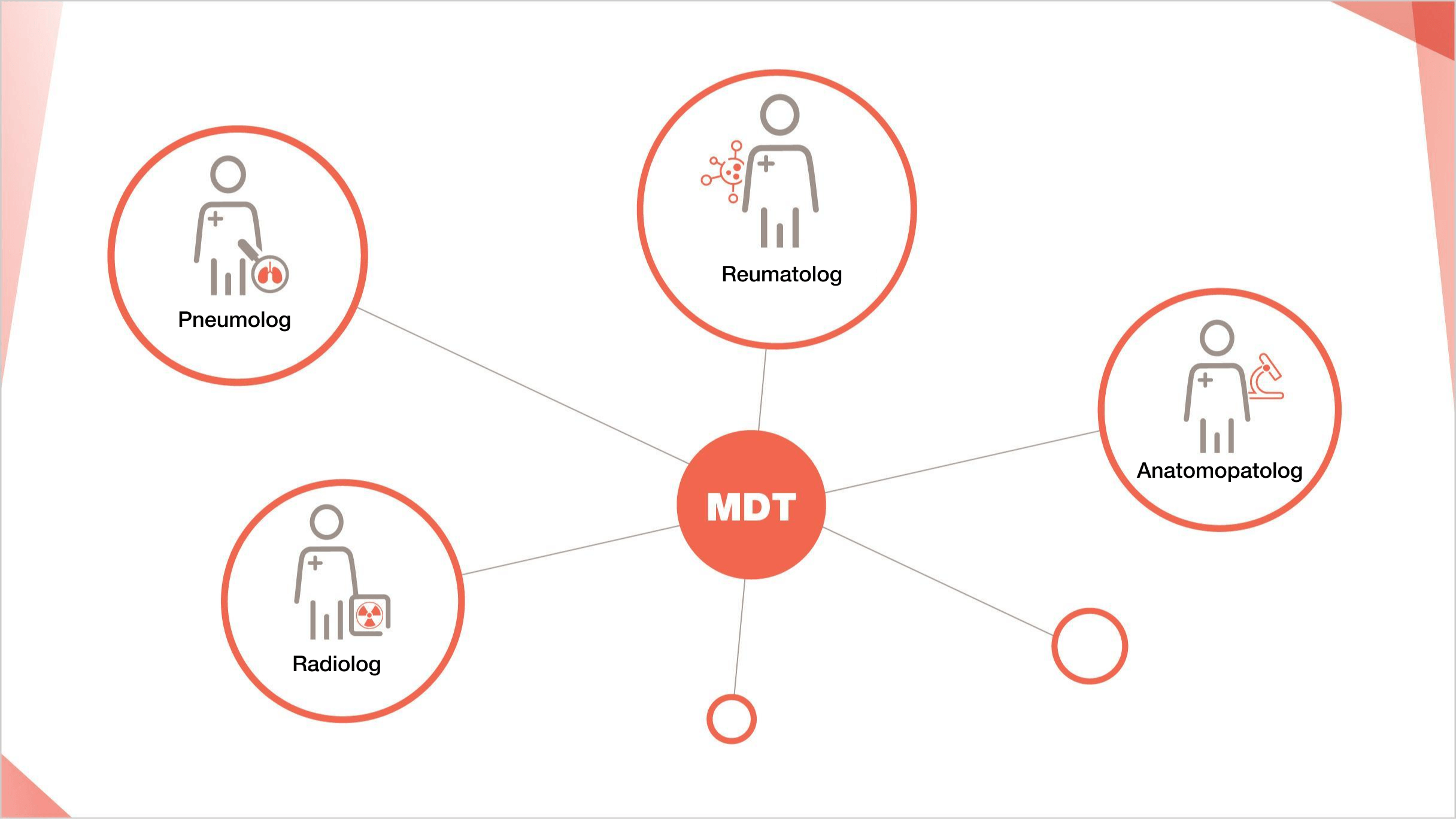
Ce alte abordări de management ar trebui să luați în considerare?

Monitorizarea precoce și regulată a progresiei PID în PID-BTC

Echipa multidisciplinară

Oferirea de îngrijiri paliative/ de susținere
Note
-
CI, interval de încredere; PID-BTC, pneumopatie interstițială difuză asociată cu boli ale țesutului conjunctiv; DLCO, factorul de transfer gazos pentru monoxid de carbon; CVF, capacitate vitală forțată; HR, hazard ratio; HRCT, tomografie computerizată de înaltă rezoluție; IIP, pneumopatie interstițială idiopatică; ILA, anomalie pulmonară interstițială; PID, pneumopatie interstițială difuză; KL-6, Krebs von den Lungen-6; NSIP, pneumopatie interstițială nespecifică; PFR, probe funcționale respiratorii; AR, artrită reumatoidă; PID-AR, pneumopatie interstițială difuză asociată cu artrita reumatoidă; DLCO factorul de transfer gazos pentru monoxid de carbon; UIP, pneumopatie interstițială uzuală.
-
- Iqbal K and Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
- Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082. doi: 10.3390/jcm9041082.
- Olson AL, Hartmann N, Padmaja P, et al. Estimation of the Prevalence of Progressive Fibrosing Interstitial Lung Diseases: Systematic Literature Review and Data from a Physician Survey. Adv Ther. 2020; https://doi.org/10.1007/s12325-020-01578-6.
- Wijsenbeek M, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019;35(11):2015–2024.
- Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: a doubleblind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res. 2017;4(1):e000212. doi: 10.1136/bmjresp-2017-000212.
- Cottin V, Hirani NA, Hotchkin DL, et al. Presentation, diagnosis and clinical course of the spectrum of progressive fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076. doi: 10.1183/16000617.0076-2018.
- Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019;28(151):180100. doi: 10.1183/16000617.0100-2018.
- Kolb M and Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1):57. doi: 10.1186/s12931-019-1022-1.
- Dawson JK, Fewins HE, Desmond J, et al. Predictors of progression of HRCT diagnosed fibrosing alveolitis in patients with rheumatoid arthritis. Ann Rheum Dis. 2002;61:517–521.
- Kawano-Dourado L, Doyle TJ, Bonfiglioli K, et al. Baseline characteristics and progression of a spectrum of interstitial lung abnormalities and disease in rheumatoid arthritis. Chest. 2020:S0012-3692(20)31412-4. doi: 10.1016/j.chest.2020.04.061.
- Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
- Esposito AJ, Chu SG, Madan R, et al. Thoracic manifestations of rheumatoid arthritis. Clin Chest Med. 2019;40(3):545–560.
- Solomon JJ, Chung JH, Cosgrove GP, et al. Predictors of mortality in rheumatoid arthritis-associated interstitial lung disease. Eur Respir J. 2016;47(2):588–596.
- Avouac J, Cauvet A, Steelandt A, et al. Improving risk-stratification of rheumatoid arthritis patients for interstitial lung disease. PLoS One. 2020;15(5):e0232978. doi:10.1371/journal.pone.0232978.
- Gochuico BR, Avila NA, Chow CK, et al. Progressive preclinical interstitial lung disease in rheumatoid arthritis. Arch Intern Med. 2008;168(2):159–166.
- Assayag D, Lee JS, King Jr TE. Rheumatoid arthritis associated interstitial lung disease: a review. Medicina (B Aires). 2014;74(2):158–165.
- Lake F and Proudman S. Rheumatoid arthritis and lung disease: from mechanisms to a practical approach. Semin Respir Crit Care Med. 2014;35(2):222–238.
- Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
- Chowaniec M, Skoczyńska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
- Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
- Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
- Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
- Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
- Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
