Monitorizarea și managementul progresiei PID în PID-BTC
Monitorizarea regulată a progresiei pneumopatiei interstițiale difuze asociate cu boala țesutului conjunctiv (PID-BTC) este vitală pentru a informa asupra asistenței medicale adecvate1

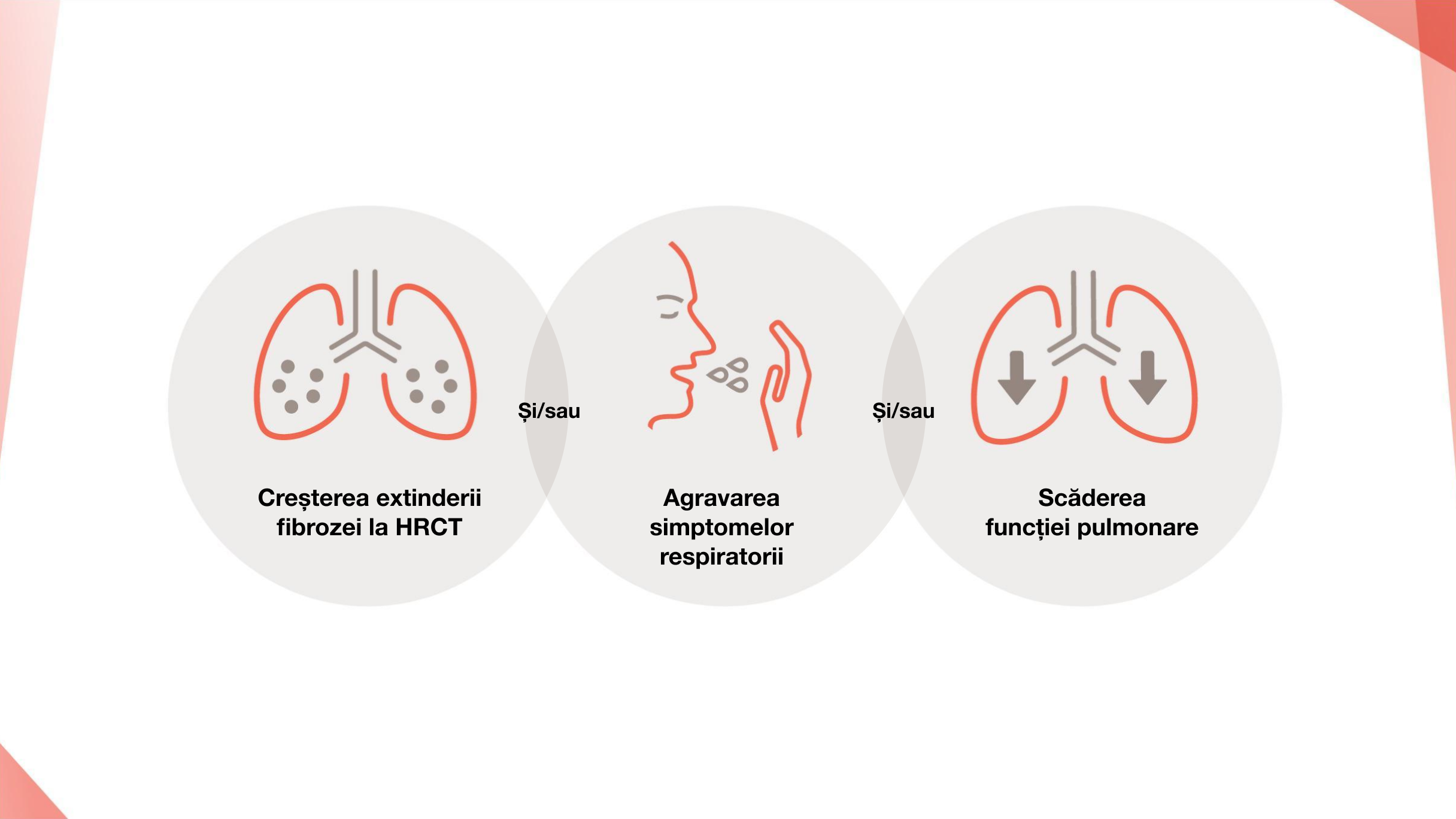
În prezent, nu există o definiție aprobată uniformă a fenotipului fibrozant progresiv11 și, în practica clinică, nici un prag sau o rată de declin nu a fost acceptată în mod oficial12
Odată ce explicațiile alternative, cum ar fi infecția tractului respirator, au fost excluse și tratate, pacienții cu PID care îndeplinesc următoarele criterii în orice moment în decurs de 24 de luni, în ciuda tratamentului în practica clinică, pot fi considerați ca având fibroză progresivă:13
Scăderea relativă de ≥10% a CVF
Scădere relativă de ≥5-<10% a CVF și scădere relativă de ≥15% a DLCO
Scăderea relativă de ≥5-<10% a CVF și agravarea simptomelor respiratorii
Scăderea relativă de ≥5-<10% a CVF și extinderea crescută a fibrozei la HRCT
Înrăutățirea simptomelor respiratorii și extinderea crescută a fibrozei la HRCT
TIMPUL ESTE VITAL ATUNCI CÂND ESTE SUSPICIONATĂ FIBROZA PROGRESIVĂ9
Detectarea întârziată a fibrozei pulmonare progresive în PID poate fi mortală. Pacienții au un timp de supraviețuire estimat la 2,5-4 ani după detectarea fibrozei progresive.4,9 Detectarea precoce a pacienților cu progresie PID fibrozantă ar putea informa deciziile de management și consilierea pacientului4
CUM AR PUTEA FI SCURTAT TIMPUL DINTRE DIAGNOSTICUL PID ȘI DETECȚIA FENOTIPULUI FIBROZANT PROGRESIV LA PACIENȚII DVS?
Un pacient cu PID-BTC ar putea aștepta în medie 2,5-3 ani de la simptomele inițiale ale PID până la diagnosticul de PID cu fibroză progresivă4*
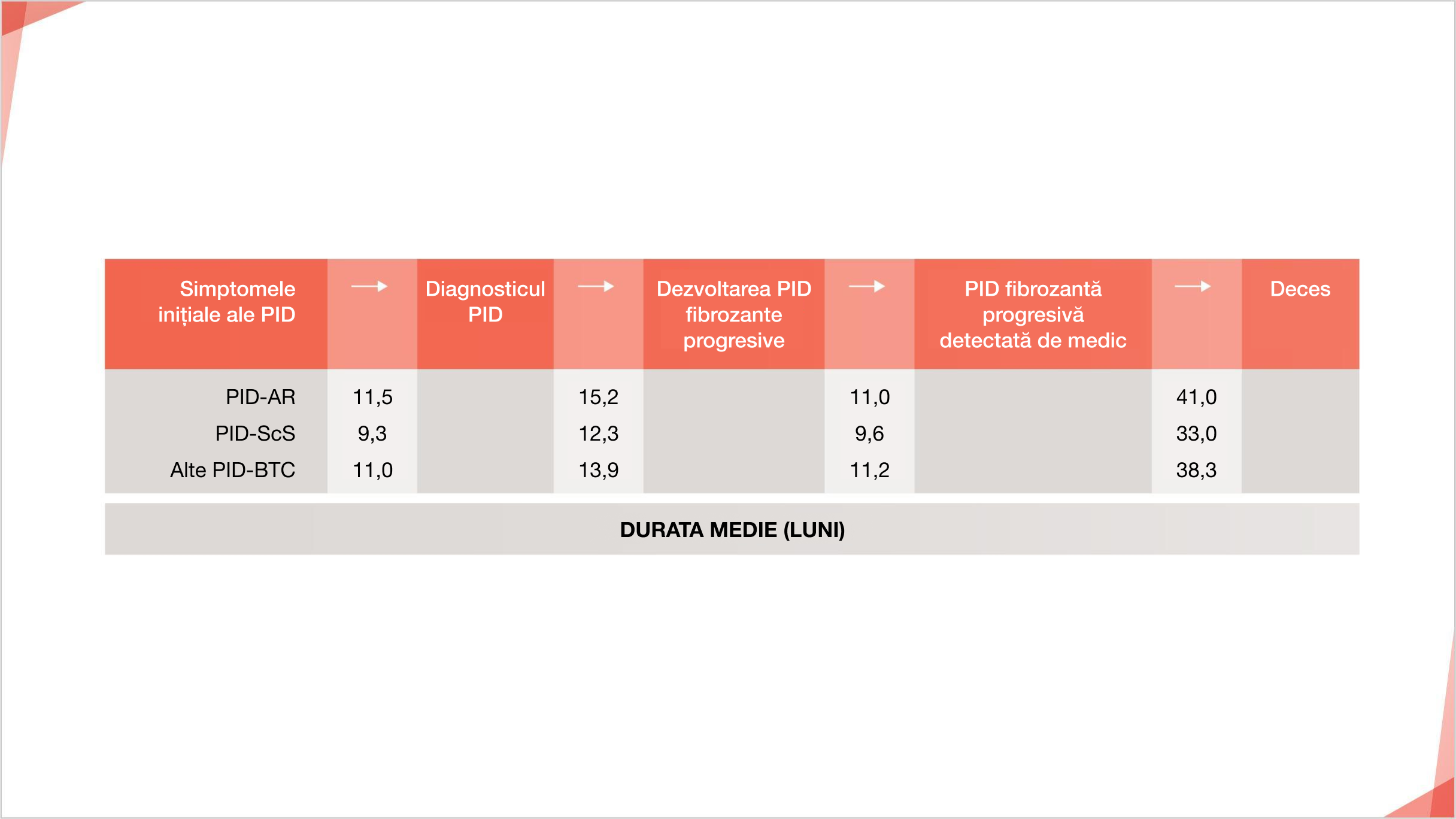
Wijsenbeek M, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management, 2019, Curr Med Res Opin. Reprint cu permisiunea editorului Informa UK Limited, denumirea comercială Taylor & Francis Ltd.
Călătoria pacientului în PID cu fibroză progresivă non-FPI este estimată într-un sondaj online al medicului
* Estimări ale pacienților cu PID non-FPI care dezvoltă fibroză progresivă, bazate pe un sondaj online cu un total de 486 de medici (243 de pneumologi, 203 de reumatologi și 40 de interniști) din Statele Unite, Japonia, Franța, Germania Spania și Regatul Unit4
ÎN PID-BTC, MONITORIZAREA PID POATE FI OPTIMIZATĂ PRIN COLABORAREA ÎNTRE SPECIALITĂȚI1
Evaluarea multidisciplinară în standardul de aur în diagnosticul PID și evaluarea severității acesteia1,4
În cazurile în care un MDT este dificil de reunit pentru un pacient cu PID, discuțiile multidisciplinare pot fi purtate virtual sau prin telefon pentru a permite fiecărui grup de specialitate să contribuie15
Măsurătorile efectuate în timpul PFR ar trebui să includă CVF, DLCO și CPT1
În ciuda limitărilor sale în identificarea PID la pacienții cu BTC, 6MWD poate fi utilizat pentru a măsura progresia PID și pentru a oferi informații de prognostic pentru PID-BTC stabilite, prin urmare, este de sugerat o evaluare regulată a 6MWD1
Conștientizarea limbajului pacientului poate ajuta la identificarea simptomelor PID în BTC16

Toți pacienții cu PID-ScS trebuie urmăriți la fiecare 3-6 luni cu PFR și repetat HRCT ghidat de decizia clinică, având în vedere progresia foarte variabilă a bolii17,18
Aflați mai multe despre monitorizarea pacienților cu PID-ScS după inițierea terapiei

Monitorizarea progresiei PID-AR cu PFR este recomandată la intervale de 3-6 luni, apoi la fiecare 6-12 luni dacă boala este stabilă19
Aflați mai multe despre monitorizarea pentru progresia PID în AR

Monitorizarea progresiei PID asociate Sindromului primar Sjögren folosind PFR este recomandată la fiecare 3-6 luni în primii 1-2 an20
Aflați mai multe despre monitorizarea progresiei PID asociată sindromului Sjögren primar
TRATAMENTUL PID-BTC CU FENOTIP FIBROZANT PROGRESIV NU TREBUIE SĂ AȘTEPTE1,14
O discuție multidisciplinară ar trebui inițiată la diagnosticarea pacienților BTC cu PID și în timpul monitorizării acestora pentru a determina abordarea optimă pentru încetinirea progresiei PID12,13.
Decizia de a trata PID-BTC se poate baza pe faptul că pacientul este afectat clinic de PID, dacă PID este progresivă prin agravarea simptomelor, fiziologiei și/sau imagisticii și ce caracteristici extra toracice necesită terapie1
Algoritm propus care prezintă recomandări generale pentru gestionarea PID la pacienții cu BTC1
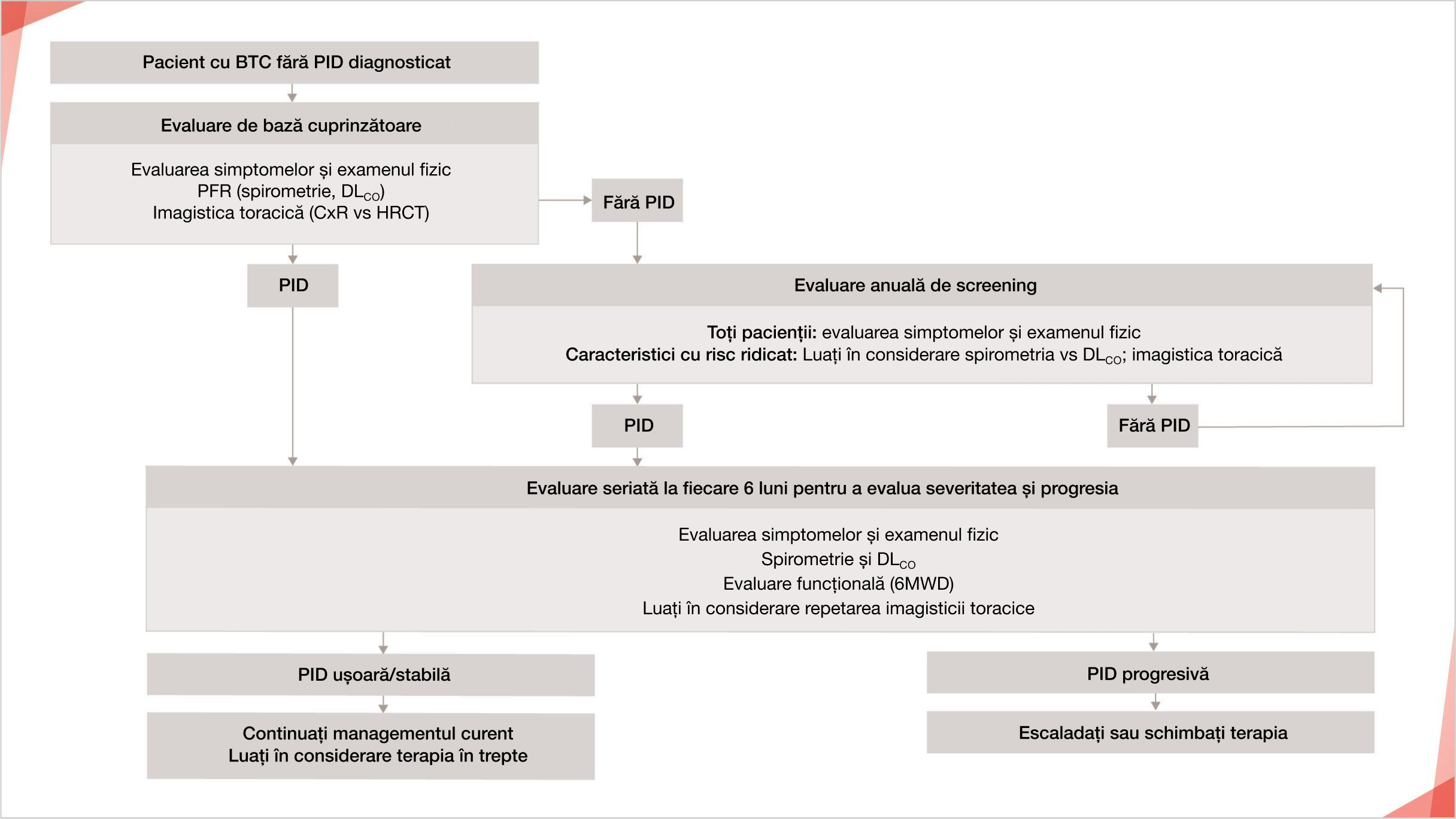
*În prezent, nu există un consens cu privire la momentul inițierii tratamentului PID-ScS
Adaptat după: Geerts S, et al. Sarcoidosis Vasc Diffuse Lung Dis. 2017;34:326-335
RECOMANDĂRILE PRIVIND MANAGEMENTUL PENTRU PID-SCS SPECIFICE TREBUIE SĂ COMPLETEZE RECOMANDĂRILE GENERALE PENTRU MANAGEMENTUL PID-BTC17,20-23
Câteva exemple sunt prezentate mai jos

Inițierea tratamentului la pacienții cu PID-ScS ar trebui să urmărească prevenirea progresiei și evitarea leziunilor pulmonare ireversibile17,21,22
Cum puteți identifica și optimiza tratamentul PID la pacienții dumneavoastră cu PID-ScS?

Progresia și severitatea PID sunt principalii factori de luat în considerare în decizia terapeutică pentru PID-AR23
Cum puteți identifica și optimiza tratamentul progresiei PID la pacienții dumneavoastră cu PID-AR?

Progresia și severitatea PID sunt principalii factori de luat în considerare în decizia terapeutică pentru PID asociată sindromului Sjögren primar20
Cum puteți identifica și optimiza tratamentul progresiei PID la pacienții dumneavoastră cu PID asociată sindromului Sjögren primar?
Cum altfel vă puteți gestiona pacienții cu PID-BTC?

Managementul PID-ScS

Oferirea de îngrijiri paliative/
de susținere

Echipe multidisciplinare
Note
-
*
Estimări ale pacienților cu PID non-FPI care dezvoltă fibroză progresivă bazate pe un sondaj online efectuat pe un total de 486 de medici (243 de pneumologi, 203 de reumatologi și 40 de interniști) din Statele Unite, Japonia, Franța, Germania, Italia. Spania și Regatul Unit4
-
†
În funcție de prognosticul general și de riscurile de progresie a PID.
-
6MWD, testul de mers pe jos timp de șase minute; BAL, lavaj bronhoalveolar; BTC boala țesutului conjunctiv; PID-BTC, pneumopatie interstițială difuză asociată cu boli ale țesutului conjunctiv; CxR, Rx toracică; DLCO, factorul de transfer gazos pentru monoxid de carbon, CVF, capacitate vitală forțată; HRCT, tomografie computerizată de înaltă rezoluție; HRQOL, calitatea vieții legate de starea de sănătate; PID, pneumopatie interstițială difuză; FPI, fibroză pulmonară idiopatică; MDD, discuție multidisciplinară; MDT, echipa multidisciplinară; PFR, probe funcționale respiratorii funcției pulmonare; PID-AR, pneumopatie interstițială difuză asociată cu artrita reumatoidă; PID-ScS, pneumopatie interstițială difuză asociată sclerozei sistemice; CPT, capacitatea pulmonară totală
- Geerts S, Wuyts W, De Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Diffuse Lung Dis. 2017;34(4):326–335.
- Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
- Olson AL, Hartmann N, Padmaja P, et al. Estimation of the Prevalence of Progressive Fibrosing Interstitial Lung Diseases: Systematic Literature Review and Data from a Physician Survey. Adv Ther. 2020; https://doi.org/10.1007/s12325-020-01578-6.
- Wijsenbeek M, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019;35(11):2015–2024.
- Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
- Hoffmann-Vold A, Aaløkken TM, Lund MB, et al. Predictive Value of Serial High-Resolution Computed Tomography Analyses and Concurrent Lung Function Tests in Systemic Sclerosis. Arthritis Rheumatol. 2015;67:2205–2212.
- Marie I, Hatron PY, Dominique S, et al. Short-Term and Long-Term Outcomes of Interstitial Lung Disease in Polymyositis and Dermatomyositis. Arthritis Rheum. 2011;63:3439–3447.
- Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
- Kolb M, Flaherty KR. The justification for the progressive fibrotic phenotype. Curr Opin Pulm Med 2021; online ahead of print.
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
- George PM, Spagnolo P, Kreuter M, et al. Progressive fibrosing interstitial lung disease: clinical uncertainties, consensus recommendations, and research priorities. Lancet Respir Med. 2020;8:925–954.
- Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10(12):728–739.
- Chung JH, Goldin JG. Interpretation of HRCT Scans in the Diagnosis of IPF: Improving Communication Between Pulmonologists and Radiologists. Lung. 2018;196:561–567.
- Mittoo S, Frankel S, LeSage D, et al. Patient perspectives in OMERACT provide an anchor for future metric development and improved approaches to healthcare delivery in connective tissue disease related interstitial lung disease (CTD-ILD). Curr Respir Med Rev. 2015;11(2):175–183.
- Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. Lancet Rheum. 2020;2:e71–e83.
- Distler O, Assassi S, Cottin V, et al. Predictors of progression in systemic sclerosis patients with interstitial lung disease. Eur Respir J. 2020;55;1902026.
- Iqbal K, Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
- Lee AS, Scofield RH, Hammitt KM, et al. Consensus guidelines for evaluation and management of pulmonary disease in Sjögren’s. Chest. 2020 Oct 20. doi: 10.1016/j. chest.2020.10.011.
- Hoffmann-Vold AM, Allanore Y, Alves M, et al. Progressive interstitial lung disease in patients with systemic sclerosis-associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020a;217455.
- Distler O, Volkmann ER, Hoffmann-Vold AM, et al. Current and future perspectives on management of systemic sclerosis-associated interstitial lung disease. Expert Rev Clin Immunol. 2019;15;1009–1017.
- Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082. doi: 10.3390/jcm9041082.
- Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
- Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
- Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
- Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
