PID-BTC cu fenotip fibrozant progresiv
Până la 10 pacienți cu pneumopatii interstițiale difuze asociate cu boli ale țesutului conjunctiv (PID-BTC) pot dezvolta un fenotip fibrozant progresiv1–5

PACIENȚII CU PID-BTC SE AFLĂ LA RISC DE A DEZVOLTA UN FENOTIP FIBROZANT PROGRESIV, INDIFERENT DE PID SUBIACENT2,6–8
Fenotipul fibrozant progresiv este definit de prezența a6–9:
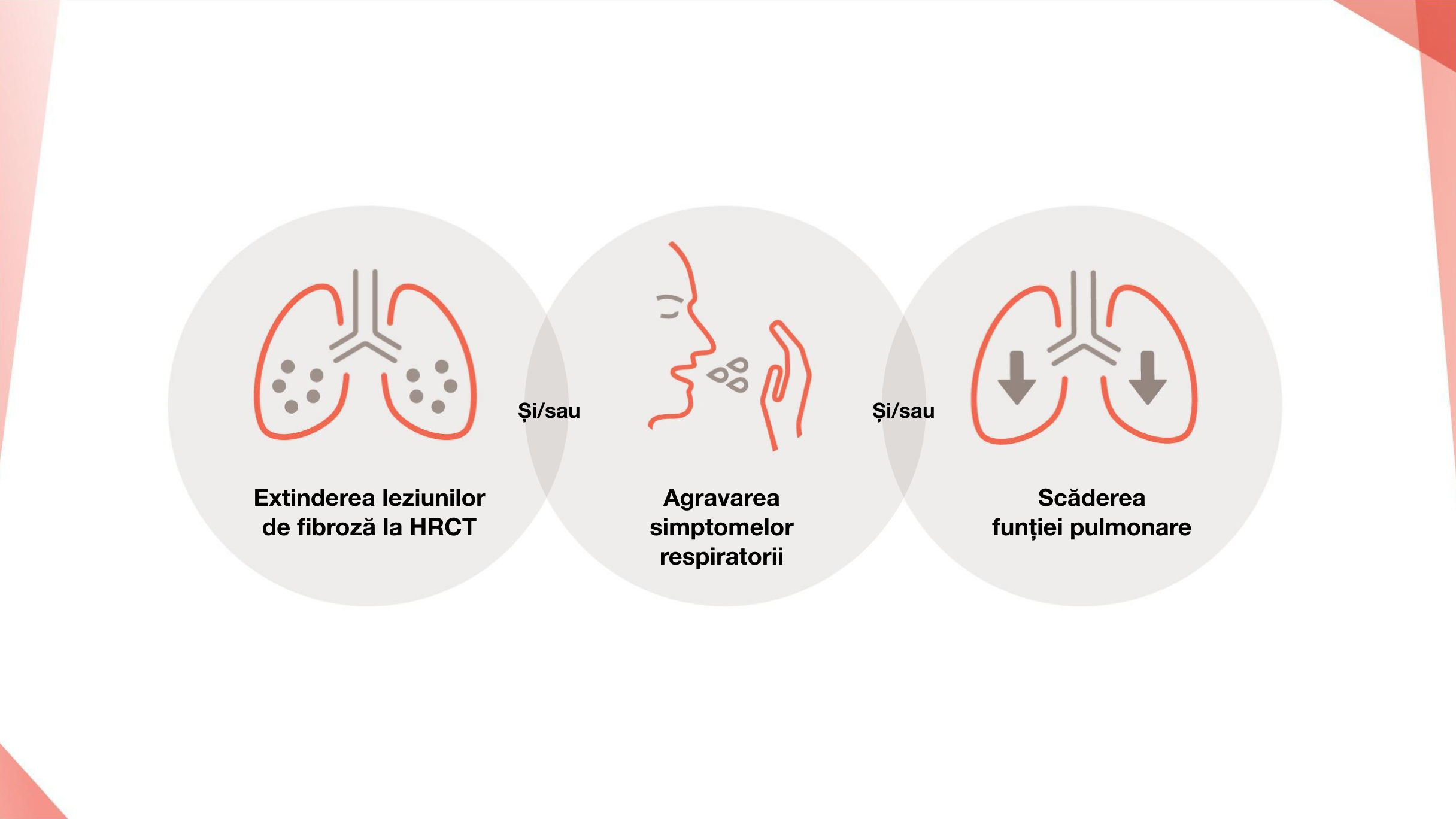
În PID cu fenotip fibrozant progresiv, fibroza pulmonară continuă să se dezvolte independent de boala subiacentă (ScS, AR, sindromul Sjögren primar etc.) sau de factorii declanșantori (inflamație, expunere etc.), de-a lungul căilor patogene comune6,9–11
PREVALENȚA FENOTIPULUI FIBROZANT PROGRESIV LA PACIENȚII CU
PID-BTC
Se estimează că 16%-40% dintre pacienții cu PID-BTC dezvoltă un fenotip fibrozant progresiv - pe baza unei revizuiri sistematice a literaturii publicate și a unui sondaj de medici1–5
PID fibrozantă | Proporția pacienților cu fenotip progresiv, % | Referință/surse |
|---|---|---|
| Artrita reumatoidă asociată pneumopatiei interstițiale difuze (PID-AR) | 40 | Zamora-Legoff 2017 |
| Pneumopatie interstițială difuză asociată sclerozei sistemice (PID-ScS) | 32 | Hoffmann-Vold 2015 |
| Pneumopatie interstițială difuză asociată cu polimiozită și dermatomiozită (PM/DM-ILD) | 16 | Marie 2011 |
| Pneumopatie interstițială difuză asociată sindromului Sjögren primar (sindromul primar Sjögren) | 24 | Wijsensbeek 2019* |
| Pneumopatie interstițială difuză asociată cu lupus eritematos sistemic (PID-LES) | 24 | Wijsensbeek 2019* |
| Pneumopatie interstițială difuză asociată cu boala țesutului conjunctiv mixt (PID-BMTC) | 24 | Wijsensbeek 2019* |
* Estimări ale procentului de pacienți cu PID non-FPI care dezvoltă fibroză progresivă pe baza unui sondaj online efectuat pe un total de 486 de medici (243 de pneumologi, 203 de reumatologi și 40 de interniști) din Statele Unite, Japonia, Franța, Germania, Italia, Spania și Regatul Unit. Procent de proveniență (24%) pentru PID - sindromul primar Sjogren, PID-LES și PID-BMTC pentru același „grup de alte PID-BTC”
POVARA FIBROZEI CU FENOTIP PROGRESIV PID-BTC POATE REDUCE SUBSTANȚIAL CALITATEA VIEȚII LEGATĂ DE STAREA DE SĂNĂTATE A PACIENTULUI9
Tusea și dispneea afectează negativ viața de zi cu zi a pacienților cu
PID-BTC15–17
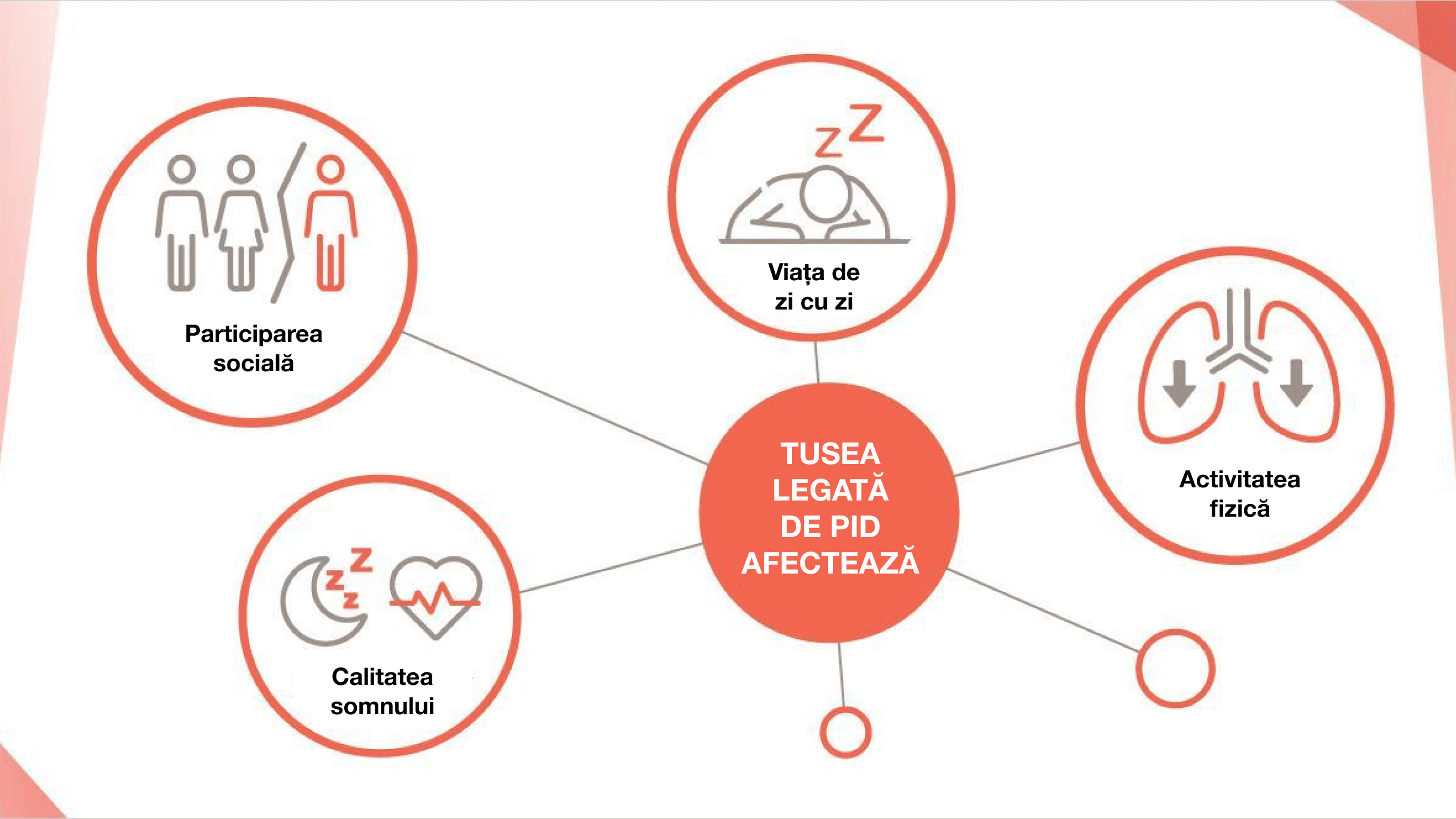
Pacienții cu PID-BTC progresiv au o suferință emoțională care poate include sentimente de depresie, anxietate și pierderea independenței.18,19
Depresie

Neputință

Pierderea independenței

Anxietate
PID-BTC AU UN IMPACT POTENȚIAL VARIABIL ASUPRA PACIENȚILOR7,18
Pacienții cu PID-BTC progresivă raportează un simptom aproape universal de anxietate și/sau depresie.18
PID fibrozant progresiv se caracterizează prin progresia fibrozei pulmonare, agravarea simptomelor, scăderea funcției pulmonare și deteriorarea calității vieții legate de sănătate.7
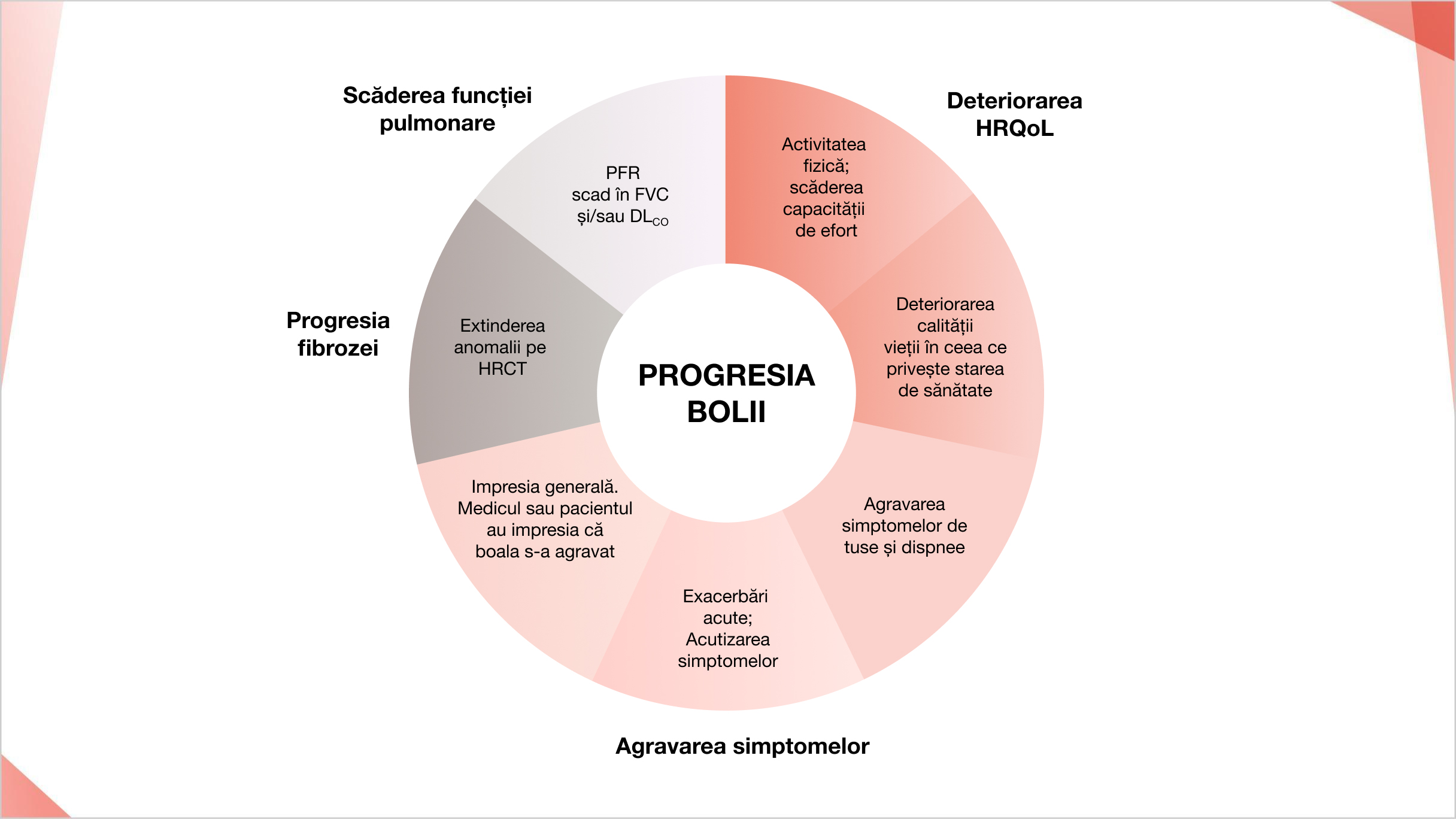
Factori care reflectă progresia PID
Adaptat după: Kolb M, Vasakova M. Respir Res. 2019;20(1).
Scăderile funcției pulmonare prezentate de PFR sunt asociate cu o mortalitate crescută la pacienții cu PID-BTC14,20–22
Primul pas pentru încetinirea progresiei PID-BTC este identificarea PID

Primul pas pentru încetinirea progresiei PID-BTC este identificarea PID
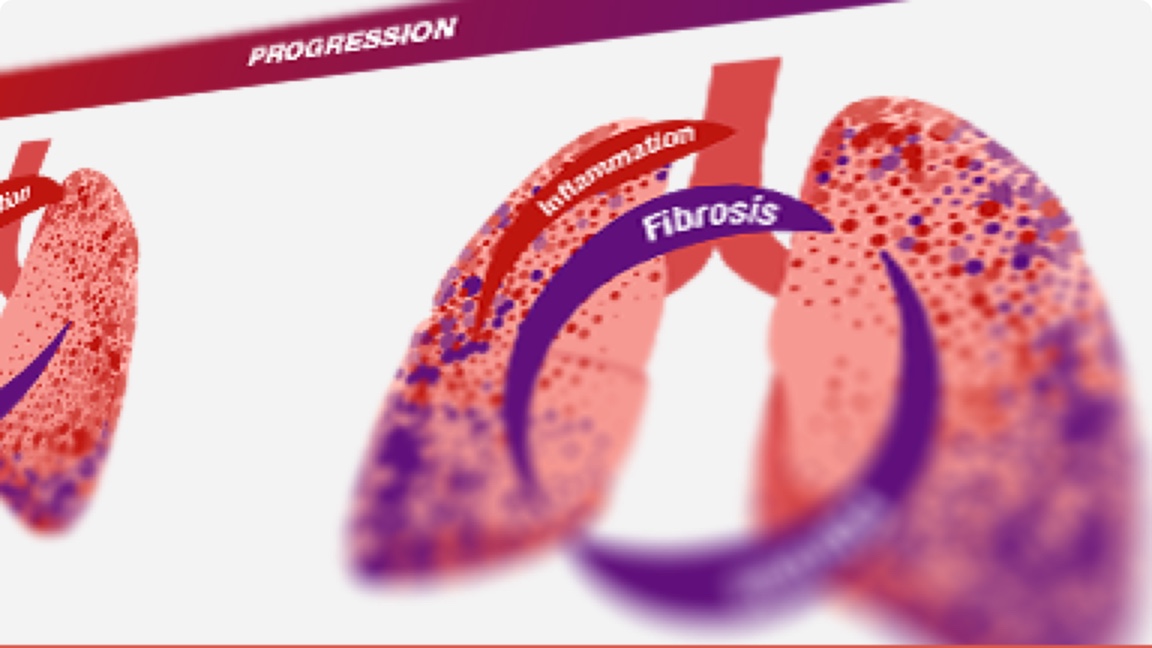
Inflamația și fibroza în PID-BTC
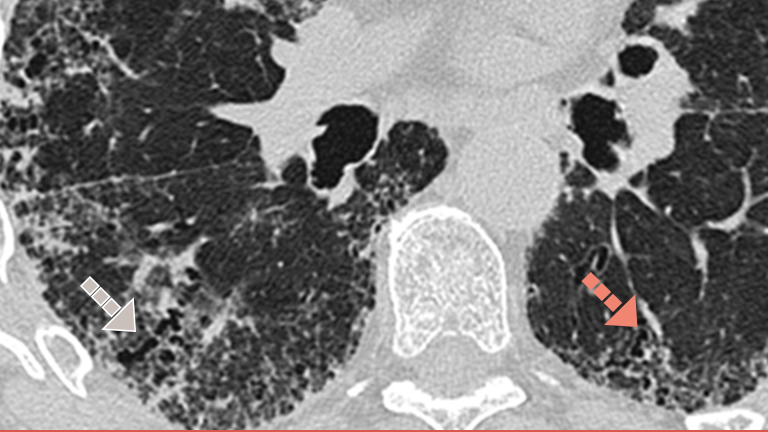
Investigarea PID-BTC fibrozante cu imagistica HRCT
Note
BTC, boala țesutului conjunctiv, PID-BTC, pneumopatie interstițială difuză asociată cu boala țesutului conjunctiv; DLCO, facotrul de transfer gazos pentru monoxidul de carbon; PID-DM, pneumopatie interstițială difuză asociată dermatomiozitei; CVF, capacitatea vitală forțată; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză; FPI, fibroză pulmonară idiopatică; PID-BMTC, pneumopatie interstițială difuză asociată bolii mixte de țesut conjunctiv; PFR, probe funcționale respiratorii; PID-PM, pneumopatie interstițială difuză asociată polimiozitei; PID-AR, pneumopatie interstițială difuză asociată artritei reumatoide; PID-ScS, pneumopatie interstițială difuză asociată sclerozei sistemice.
- Olson AL, Hartmann N, Padmaja P, et al. Estimation of the Prevalence of Progressive Fibrosing Interstitial Lung Diseases: Systematic Literature Review and Data from a Physician Survey. Adv Ther. 2020; https://doi.org/10.1007/s12325-020-01578-6.
- Wijsenbeek MS, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019:1–10.
- Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
- Hoffmann-Vold A, Aaløkken TM, Lund MB, et al. Predictive Value of Serial High-Resolution Computed Tomography Analyses and Concurrent Lung Function Tests in Systemic Sclerosis. Arthritis Rheumatol. 2015;67:2205–2212.
- Marie I, Hatron PY, Dominique S, et al. Short-Term and Long-Term Outcomes of Interstitial Lung Disease in Polymyositis and Dermatomyositis. Arthritis Rheum. 2011;63:3439–3447.
- Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
- Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
- Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019;28(151):180100. doi: 10.1183/16000617.0100-2018.
- Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
- Selman M, King TE, Pardo A; American Thoracic Society; European Respiratory Society; American College of Chest Physicians. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134(2):136–151.
- Bagnato G, Harari S. Cellular interactions in the pathogenesis of interstitial lung diseases. Eur Respir Rev. 2015;24(135):102–114.
- Wijsenbeek M, Kreuter M, Fischer A, et al. Non-IPF Progressive Fibrosing Interstitial Lung Disease (PF-ILD): The Patient Journey. Am J Respir Crit Care Med. 2018;197:A1678.
- Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. Lancet Rheum. 2020;2:e71–e83.
- Guler, S.A., Winstone, T.A., Murphy, D., et al. Does systemic sclerosis–associated interstitial lung disease burn out? Specific phenotypes of disease progression. Annals ATS. 2018;15;1427–1433.
- Saketkoo LA, MMittoo S, Huscher D, et al. Connective tissue disease related interstitial lung diseases and idiopathic pulmonary fibrosis: provisional core sets of domains and instruments for use in clinical trials. Thorax. 2014;69(5):428–436.
- Saketkoo LA, Scholand MB, Lammi MR, et al. Patient-reported outcome measures in systemic sclerosis–related interstitial lung disease for clinical practice and clinical trials. Scleroderma Relat Disord. 2020;5(2 Suppl):48–60.
- Mittoo S, Frankel S, LeSage D, et al. Patient perspectives in OMERACT provide an anchor for future metric development and improved approaches to healthcare delivery in connective tissue disease related interstitial lung disease (CTD-ILD). Curr Respir Med Rev. 2015;11:175–183.
- Morisset J, Dubé B, Garvey C, et al. The Unmet Educational Needs of Patients with Interstitial Lung Disease: Setting the Stage for Tailored Pulmonary Rehabilitation. Ann Am Thorac Soc. 2016;13:1026–1033.
- Swigris JJ, Brown KK, Abdulqawi R, et al. Patients’ perceptions and patient-reported outcomes in progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180075.
- Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200;1258–1266.
- Goh NS, Hoyles RK, Denton CP, et al. Short-term pulmonary function trends are predictive of mortality in interstitial lung disease associated with systemic sclerosis. Arthritis Rheumatol. 2017;69;1670–1678.
- Walsh SLF, Sverzellati N, Devaraj A, et al. Connective tissue disease related fibrotic lung disease: high resolution computed tomographic and pulmonary function indices as prognostic determinants. Thorax. 2014;69(3):216–222.
- Chowaniec M, Skoczyńska M, Sokolik R, et al. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56;249–254.
- Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
- Maher TM, Wuyts W. Management of fibrosing interstitial lung diseases. Adv Ther. 2019;36(7);1518–1531.
- Wuyts WA, Agostini C, Antoniou KM, et al. The pathogenesis of pulmonary fibrosis: a moving target. Eur Respir J. 2013;41(5):1207–1218.
- Geerts S, Wuyts W, De Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Diffuse Lung Dis. 2017;34(4):326–335.
- Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
