Monitorizarea și managementul progresiei PID în PID-SSp
Monitorizarea regulată a progresiei pneumopatiei interstițiale difuze asociate cu sindromul Sjögren primar (PID-SSp) poate determina deciziile adecvate de tratament1

MONITORIZAREA PROGRESIEI PID-ScS PRIN UTILIZAREA PFR ESTE RECOMANDATĂ LA FIECARE 3–6 LUNI ÎN PRIMII 1–2 ANI1
Fenotipul fibrozant progresiv este definit de prezenţa:4-7
Creșterea gradului de fibroză la HRCT

Agravarea simptomelor respiratorii
Scăderea funcției pulmonare

Vârsta
S-a demonstrat că vârsta înaintată la debutul bolii este asociată cu progresia PID la pacienții cu PID-SSp (p=0,015)8,9*

Clinic
VSH crescut la momentul inițial este asociat în mod semnificativ cu progresia PID la pacienții cu PID-SSp (p=0,030)8*
Altele
Într-un studiu retrospectiv multicentric, pacienții cu SSp și PID fibrozantă progresivă (n=7) au avut mai frecvent implicare digestivă decât pacienții cu PID stabilă/ameliorată (n=12) [57,1% vs. 8,3%, p=0,038]9*

Dificultăți de respirație moderate la efort (NHYA II)
sau PFR limitate la CVF între 60-80% din valoarea prezisă sau DLco între 40%-70% din valoarea prezisă
Dificultăți de respirație severă/ ridicată în repaus (NHYA III, IV)
sau PFR cu CVF <60% din valoarea prezisă sau DLCO <40% din valoarea prezisă
PROGRESIA ȘI SEVERITATEA PID SUNT PRINCIPALII FACTORI DE LUAT ÎN CALCUL ÎN LUAREA DECIZIILOR TERAPEUTICE PENTRU PACIENȚII CU PID-SSp1
Ar trebui efectuată o revizuire critică a HRCT pentru a determina modelul primar la pacienții cu PID-SSp care nu răspund la tratamentul de primă linie sau care se deteriorează și ar trebui luate în considerare diferite opțiuni de tratament.1
Tratamentul pentru PID-SSp trebuie intensificat atunci când PID progresează.1 Dacă pacienții cu PID-SSp dezvoltă un fenotip fibrozant progresiv PID, trebuie luat imediat în considerare tratamentul adecvat.1
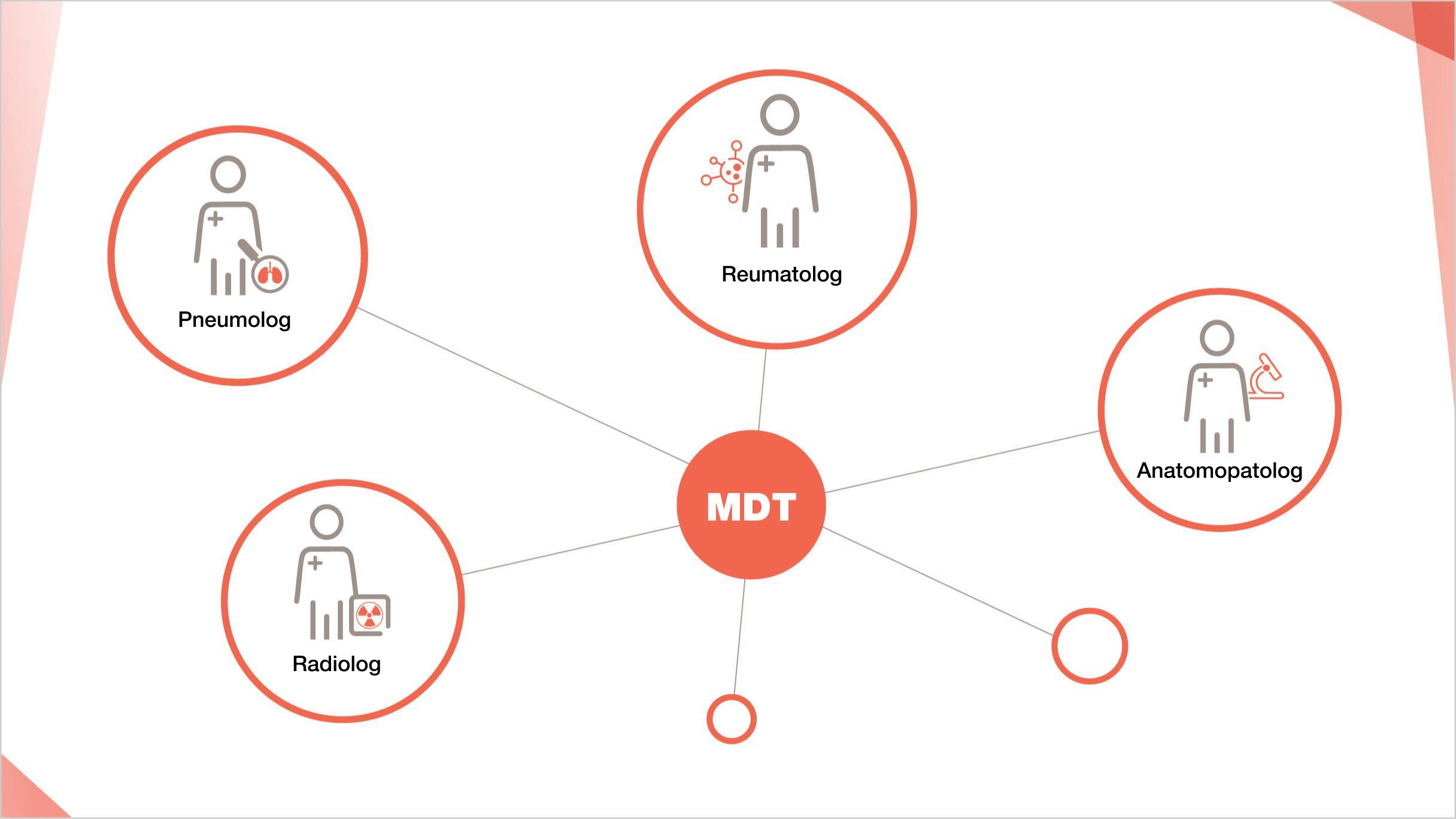
CUM AR PUTEA O ECHIPĂ MULTIDISCIPLINARĂ SĂ ÎMBUNĂTĂȚEASCĂ MANAGEMENTUL PACIENȚILOR CU PID-SSp?
Managementul multidisciplinar care include reumatologi și penumologi are un rol esențial în optimizarea îngrijirii pacienților cu PID-SSp1,11
Ce alte abordări de management ar trebui să luați în considerare?

Monitorizarea precoce și regulată a progresiei PID în PID-BTC

Oferirea de îngrijiri paliative/ de susținere
Echipa multidisciplinară
Note
-
* Progresia PID este definită prin scăderi de ≥10% în CVF și/sau ≥15% în DLCO. PID-BTC, pneumopatie interstițială difuză asociată cu boli ale țesutului conjunctiv; DLCO, factorul de transfer gazos pentru monoxid de carbon; VSH, viteza de sedimentare a eritrocitelor; CVF, capacitate vitală forțată; HRCT, tomografie computerizată de înaltă rezoluție; PID, pneumopatie interstițială difuză; NSIP, pneumopatie interstițială nespecifică; NYHA, Asociația Inimii din New York; PFR, probe funcționale respiratorii pulmonare; SSp, sindromul Sjögren primar; PID-SSp, pneumopatie interstițială difuză asociată sindromului Sjögren primar; UIP, pneumopatie interstițială uzuală.
-
- Lee AS, Scofield RH, Hammitt KM, et al. Consensus guidelines for evaluation and management of pulmonary disease in Sjögren’s. Chest. 2020 Oct 20. doi: 10.1016/j. chest.2020.10.011.
- Olson AL, Hartmann N, Padmaja P, et al. Estimation of the Prevalence of Progressive Fibrosing Interstitial Lung Diseases: Systematic Literature Review and Data from a Physician Survey. Adv Ther. 2020; https://doi.org/10.1007/s12325-020-01578-6.
- Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
- Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: a doubleblind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res. 2017;4(1):e000212. doi: 10.1136/bmjresp-2017-000212.
- Cottin V, Hirani NA, Hotchkin DL, et al. Presentation, diagnosis and clinical course of the spectrum of progressive fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076. doi: 10.1183/16000617.0076-2018.
- Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019;28(151):180100. doi: 10.1183/16000617.0100-2018.
- Kolb M and Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1):57. doi: 10.1186/s12931-019-1022-1.
- Zhang T, Yuan F, Xu L, Sun W, Liu L, Xue J. Characteristics of patients with primary Sjögren’s syndrome associated interstitial lung disease and relevant features of disease progression. Clin Rheumatol. 2020;39(5):1561–1568.
- Roca F, Dominique S, Schmidt J, et al. Interstitial lung disease in primary Sjögren’s syndrome. Autoimmun Rev. 2017;16(1):48–54.
- Flament T, Bigot A, Chaigne B, Henique H, Diot E, Marchand-Adam S. Pulmonary manifestations of Sjögren’s syndrome. Eur Respir Rev. 2016;25(140):110–123.
- Manfredi A, Sebastiani M, Cerri S, et al. Prevalence and characterization of non-sicca onset primary Sjögren syndrome with interstitial lung involvement. Clin Rheumatol. 2017;36(6):1261–1268.
- Chowaniec M, Skoczyńska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
- Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
- Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
- Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
- Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
- Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
- Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
