IDENTIFICAREA PID-SCS NECESITĂ UN NIVEL ÎNALT DE PREZUMȚIE, DEOARECE NU TOȚI PACIENȚII PREZINTĂ SIMPTOME RESPIRATORII6
Cele mai frecvente simptome inițiale ale PID-ScS sunt oboseala, dispneea de efort și tusea uscată, deși PID-ScS precoce este adesea asimptomatică.7 Luând în considerare doar prezența sau severitatea simptomelor respiratorii de ex. dispneea de efort în definirea prevalenței implicării pulmonare, poate duce la omiterea diagnosticului pentru o mare minoritate de pacienți cu PID-ScS cu pneumopatie interstițială difuză8. CVF este anormală la momentul inițial și/sau scade în timp, indiferent dacă pacienții sunt simptomatici.9
Examenul fizic evidențiază în mod obișnuit raluri asemănătoare celor crepitante la auscultația pulmonară, în plus față de constatările cutanate asociate cu ScS.10
Cele mai frecvente semne și simptome ale PID-ScS*
| Simptomele PID-ScS | Semne de PID-ScS |
|---|---|
* PID-ScS precoce poate fi asimptomatică.13,15
PACIENȚII CU ScS TREBUIE SUPUȘI UNEI INVESTIGAȚII HRCT PULMONAR DE BAZĂ PENTRU PID1,2,5
Pacienții cu ScS trebuie să primească o evaluare clinică amănunțită, inclusiv imagistica toracică cu HRCT și PFR, DLCO și auscultație pulmonară pentru a asigura identificarea precoce a PID și pentru a oferi măsurători de bază pentru a le compara cu evaluările viitoare.1,4,6,13
Algoritm de screening și diagnostic pentru PID-ScS1
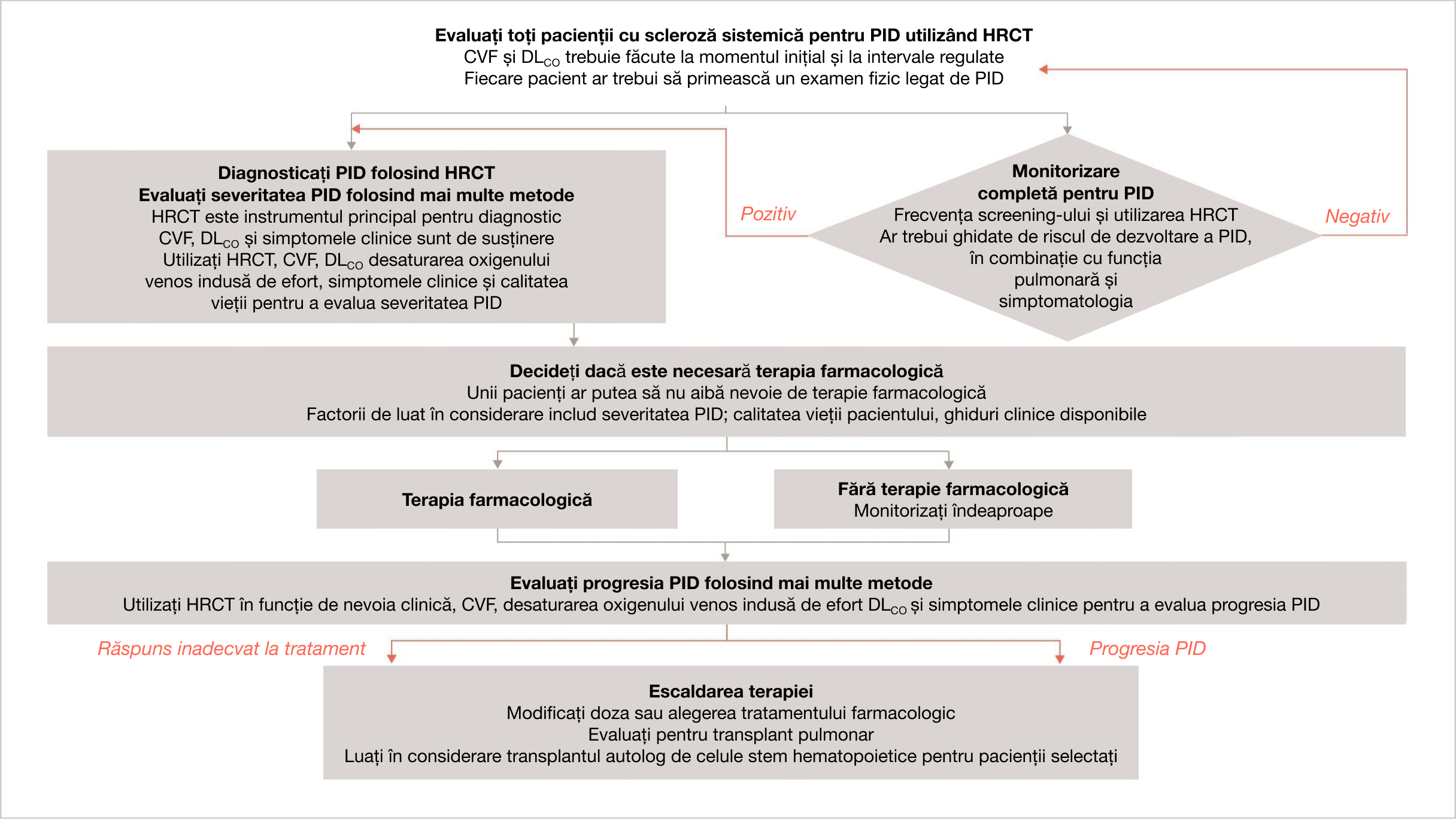
Acest algoritm oferă un scurt rezumat al declarațiilor de consens european bazate pe dovezi, inclusiv procesul suplimentar Delphi, din opinia experților a comitetului de coordonare pentru identificarea și gestionarea PID-ScS, pentru utilizare în practica clinică.
Acest articol a fost publicat în The Lancet Rheumatology, 2(2), Hoffmann-Vold et al, The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements, E71-E83, Copyright Elsevier 2022
PFR ca metodă unică de screening pentru PID-ScS poate determina clinicienii să rateze un număr semnificativ de pacienți, având în vedere rata mare de rezultate fals negative.9,13 PFR ca metodă de screening este limitată de limitele largi ale PFR (de exemplu, 80–120% din valoarea medie înregistrată în populațiile de referință potrivite pentru vârstă și sex) ceea ce poate face dificilă interpretarea datelor de screening.14
Riscul de mortalitate precoce din cauza PID18,19 evidențiază importanța screening-ului inițial pentru PID la pacienții cu ScS.1,5
Fibroza pulmonară este principala cauză de mortalitate în ScS, reprezentând ~35% din decesele legate de ScS15,16
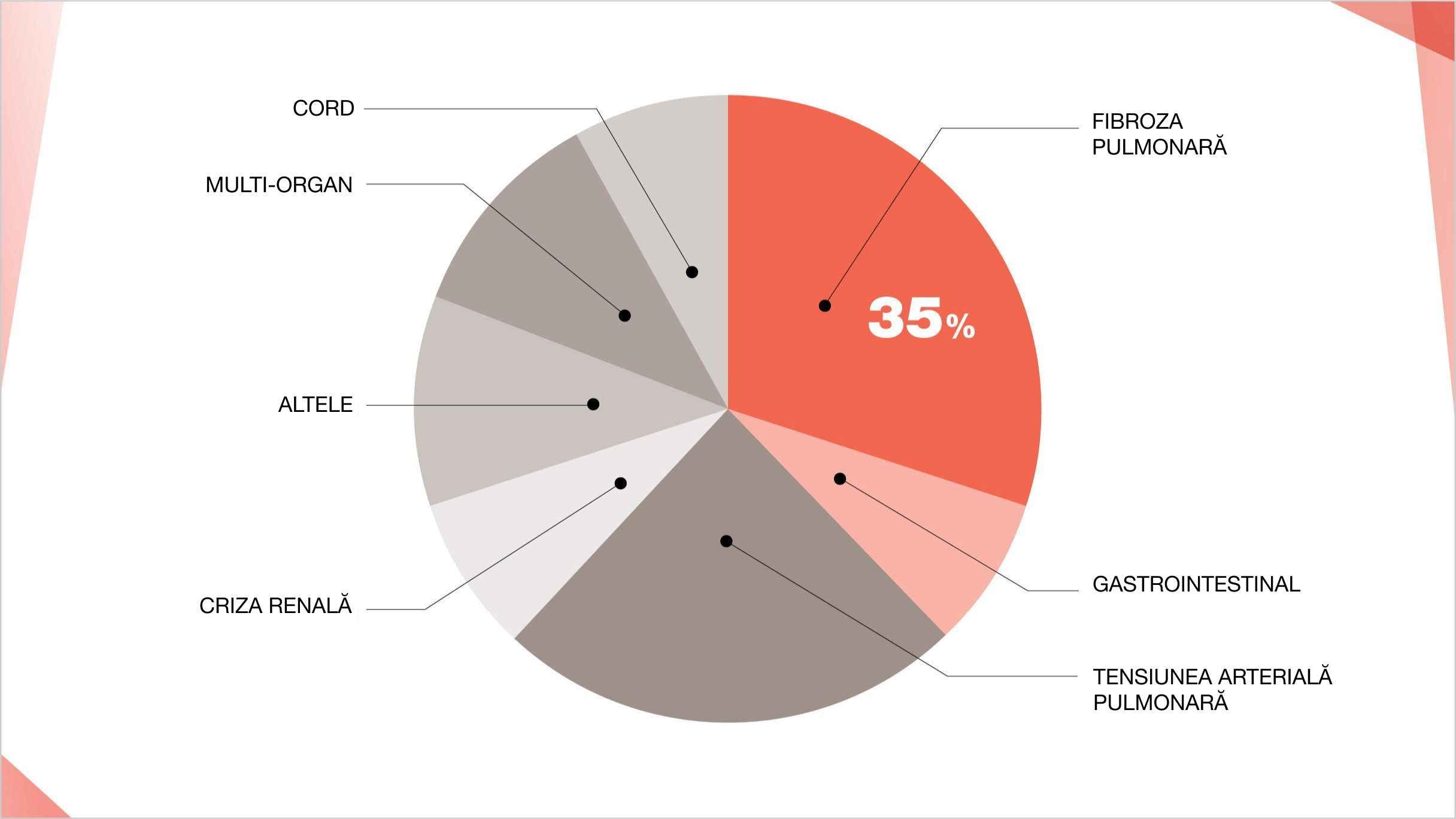
Cauzele deceselor legate de SSc (1997–2001).
Adaptat după: Steen VD and Medsger TA. Ann Rheum Dts. 2007;66:940-944 and Tyndall AJ. et al. Ann Rheum Dts. 2010:69(10):1809-1815.
Ștefania are PID-ScS
Cum poți ajunge la un diagnostic PID-ScS?
Odată ce ați ajuns la un diagnostic, cum ar trebui să vă gestionați pacienții cu PID-ScS?

Managementul PID-ScS

Monitorizare continuă în PID-ScS
paliativă/de susținere

Oferirea de îngrijiri paliative/de susținere
a sprijinii pacienții cu modalități de tratament
non-farmacologic cum ar fi mindfulness19-22
Note
-
PID-BTC, pneumopatie interstițială difuză asociată cu boli ale țesutului conjunctiv; DLCO, factorul de transfer gazos pentru monoxid de carbon; CVF, capacitate vitală forțată; HRCT, tomografie computerizată de înaltă
rezoluție; PID, pneumopatie interstițială difuză; PFR probe funcționale respiratorii; ScS, scleroză sistemică; PID-ScS pneumopatie interstițială difuză asociată sclerozei sistemice.
- Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. Lancet Rheum. 2020;2 e71–e83.
- Asano Y, Jinnin M, Kawaguchi Y, et al. Diagnostic criteria, severity classification and guidelines of systemic sclerosis: Guideline of SSc. J Dermatol. 2018;45;633–691.
- Denton CP, Khanna D. Systemic sclerosis. Lancet. 2017;390;1685–1699.
- Roofeh D, Jaafar S, Vummidi D, et al. Management of systemic sclerosis-associated interstitial lung disease. Curr Opin Rheumatol. 2019;31;241–249.
- Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200;1258–1266.
- Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc-ILD). Respir Res. 2019;20:13.
- Volkmann ER, Tashkin DP. Treatment of systemic sclerosis–related interstitial lung disease: a review of existing and emerging therapies. Annals ATS. 2016;13:2045–2056.
- Wells AU. Interstitial lung disease in systemic sclerosis. La Presse Médicale. 2014;43:e329–e343.
- Chowaniec M, Skoczyńska M, Sokolik R, et al. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56:249–254.
- Perelas A, Silver RM, Arrossi AV, et al. Systemic sclerosis-associated interstitial lung disease. Lancet Respir Med. 2020;8;304–320.
- Herzog EL, Mathur A, Tager AM, et al. Review: interstitial lung disease associated with systemic sclerosis and idiopathic pulmonary fibrosis: How similar and distinct?: SSc-Associated ILD and IPF. Arthritis Rheumatol. 2014;66;1967–1978.
- Distler O, Assassi S, Cottin V, et al. Predictors of progression in systemic sclerosis patients with interstitial lung disease. Eur Respir J. 2020;55;1902026.
- Hoffmann-Vold A, Aaløkken TM, Lund MB, et al. Predictive Value of Serial High-Resolution Computed Tomography Analyses and Concurrent Lung Function Tests in Systemic Sclerosis. Arthritis Rheumatol. 2015;67:2205–2212.
- Molberg Ø, Hoffmann-Vold AM. Interstitial lung disease in systemic sclerosis: progress in screening and early diagnosis. Curr Opin Rheumatol. 2016;28:613–618.
- Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972-2002. Ann Rheum Dis. 2007;66:940–944.
- Tyndall AJ, Bannert B, Vonk M, et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis. 2010;69:1809–1815.
- Hoffmann-Vold AM, Allanore Y, Alves M, et al. Progressive interstitial lung disease in patients with systemic sclerosis-associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020;217455.
- Distler O, Volkmann ER, Hoffmann-Vold AM, et al. Current and future perspectives on management of systemic sclerosis-associated interstitial lung disease. Expert Rev Clin Immunol. 2019;15:1009–1017.
- Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
- Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
- Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
- Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.

